
 |
 |
|
Представлена версия документа, предназначенная для печати
Вы можете загрузить эту страницу на сайте
Многолетние исследования карантинного вредителя растений американской белой бабочки (АББ) в различных популяциях на территории России показали, что существующая практика обязательного применения против адвентивного вида химических истребительных мер не только не приводит к его уничтожению, но, напротив, провоцирует возникновение "пестицидного синдрома". Возникает необходимость в перманентных химических обработках со всем шлейфом отрицательных их последствий. Показано, что АББ в новом ареале быстро включается в круг жертв (хозяев) автохтонных паразитов и хищников. Сохранение полезной энтомофауны в результате полного отказа от применения химических пестицидов или замены их бактериальными препаратами позволяет выйти из порочного круга, порождаемого "пестицидным синдромом". При этом под воздействием местных полезных беспозвоночных плотность популяций АББ снижается до уровня ниже порогового. Рост очагов ее прекращается. Сокращение периодически возрастающей ее численности требует таких же мер, какие применяются и против аборигенных растительноядных вредителей. В результате появляется возможность изменить статус АББ и вывести ее из перечня карантинных объектов. Подобный подход может быть предпринят и в отношении ряда других адвентивных вредителей растений.
Видовое разнообразие насекомых и клещей в агроценозах, где хозяйственный интерес диктует необходимость выращивания монокультуры, существенно меньше, чем в окружающих природных биоценозах. Основная причина этого – резкое снижение количества трофических ниш и убежищ. Преимущество в таких обедненных ценозах получает ограниченный круг растительноядных видов. Помимо обширной благоприятной кормовой базы, увеличению их численности способствует сокращение здесь видового состава паразитических и хищных видов. В результате плотность популяций немногих растительноядных насекомых и клещей превышает пороговый уровень, и они приобретают статус вредителей. Реальная угроза потери урожая вынуждает применять истребительные меры – как правило, тотальные обработки защищаемой культуры химическими пестицидами.
Применение пестицидов вызывает еще большее сокращение видового состава обитателей агроценоза. Помимо целевых объектов, уничтожаются наиболее уязвимые открыто живущие представители энтомофауны (в том числе имаго паразитических и хищные членистоногие). Выживают, напротив, скрыто живущие хорошо защищенные виды (минеры, плодожорки, кокциды), а также те, которые интенсивно размножаются и способны быстро вырабатывать резистентность к пестицидам (тли, листоблошки, белокрылки, цикадки, клещи). Стремительное увеличение численности таких видов превращает их в так называемых "вторичных" вредителей.
Расширение состава вредящих видов (наряду с непрекращающимися вспышками численности "первичных" вредителей) вынуждает чаще применять пестициды. Возникает порочный замкнутый круг, который в прикладной энтомологии именуется "пестицидным синдромом ". Выход из подобной ситуации возможен лишь на пути замены традиционной системы защиты растений, основанной на принципах борьбы с вредителями, новой стратегией – интегрированным контролем численности вредных организмов (integrated pest management, IPM). Этот подход основывается на новейших приемах мониторинга видового состава, численности и фенологии не только вредных, но и полезных членов агробиоценоза с использованием всех возможных (преимущественно биологического) методов контроля численности целевых объектов (видов-мишеней). Он повсеместно внедряется в сельскохозяйственную практику передовых стран. Все большее распространение получает он и в России (Зубков, 1995).
Появление нового адвентивного растительноядного насекомого со статусом карантинного вредителя вынуждает отказываться от экологически приемлемой системы IPM и возвращаться к порочной с точки зрения экологической целесообразности стратегии борьбы с вредителем. К этому фактически вынуждает “Устав карантинной службы Российской Федерации” и "Правила по охране территории Российской Федерации от карантинных вредителей, болезней и сорняков" (1992), в соответствии с которыми "борьба с карантинными объектами проводится до их полной ликвидации", не зависимо от того, где они обосновались – в агроценозе или в природных стациях. Именно такой подход ведет к резкому обеднению энтомофауны и порождает “пестицидный синдром”.
Авторы ставили перед собой задачу разработать концепцию восстановления природных энтомокомплексов, разрушенных в результате применения против адвентивных (карантинных) растительноядных насекомых экологически не обоснованных систем защиты растений и карантинных мероприятий 1). Модельным объектом выбран карантинный растительноядный вид – американская белая бабочка Hyphantria cunea Drury.
Американская белая бабочка (АББ) (Hyphantria cunea Drury) – вид североамериканского происхождения; в 40-е гг. была занесена на Европейский континент. На территории бывшего СССР впервые обнаружена в Закарпатской обл. в 1952 г. С тех пор она считается опасным карантинным вредителем шелковицы, плодовых культур, многочисленных декоративных и лесных древесных и кустарниковых растений. Европейский ареал ее непрерывно расширяется. В настоящее время его восточная граница достигла р. Волги.
Исследования проводили в зонах с различными ландшафтно-экологическими условиями: на юге Ставропольского края (предгорная зона), в Астраханской и Волгоградской областях. Первый регион характеризуется богатым флористическим разнообразием и энтомофауной с большим числом растительноядных, хищных и паразитических видов. АББ проникла сюда в 1978 г. Во втором регионе она появилась в 1983-1985 гг. В обоих регионах проводили полевые исследования и здесь же собирали необходимые документальные сведения о динамике очагов АББ, о тактике и результатах борьбы с нею в предшествующие годы. Часть материала получена при исследованиях в Краснодарском крае и Калмыкии; привлекался также полученный нами ранее материал по Закарпатской области Украины.
Изучение видового состава паразитов бабочки вели исключительно методом их выведения из яиц, гусениц всех возрастов и куколок на протяжении обеих генераций (Шаров, Ижевский, 1987). Хищников выявляли в процессе их питания в природных стациях обитания бабочки (Бельская и др., 1985) и при лабораторном выкармливании (Шаров и др., 1985).
В работе частично использованы данные, полученные в Пятигорской карантинной лаборатории В. А .Совершеновой, за предоставление которых мы ей благодарны.
Во вновь возникающих очагах АББ поражается значительным комплексом аборигенных паразитов и хищников. Последние переходят на новый вид с наиболее распространенных в местах его обитания автохтонных растительноядных насекомых. При сопоставлении комплексов энтомофагов, паразитирующих на аборигенах, с энтомофагами, уничтожающими АББ, обнаружено большое количество общих видов (табл. 1). Это свидетельствует о существовании в природе мощного потенциального механизма сдерживания численности нового адвентивного вредителя. (Подобная ситуация складывается отнюдь не всегда; например, у колорадского жука такой механизм в Европе отсутствует).
| № п.п. | Вид | Общие с АББ энтомофаги |
| 1 | Листовертка сетчатая – Adoxophyes orana F.R. | 1 |
| 2 | Пяденица пушистая – Alsophila aescularia Schiff. | 1 |
| 3 | Пирамидальная совка – Amphipyra pyramidoides Guen. | 2 |
| 4 | Боярышница – Aporia crataegi L. | 22 |
| 5 | Листовертка-толстушка боярышниковая – Archips crataegana Hb. | 2 |
| 6 | Листовертка-толстушка всеядная – Ar. podana Scop. | 1 |
| 7 | Листовертка розанная – Ar. rosana L. | 17 |
| 8 | Листовертка пестро-золотистая – Ar. xylosteana L. | 5 |
| 9 | Краснохвост – Dasychira pudibunda L. | 8 |
| 10 | Пяденица-обдирало – Eranhis defoliaria Cl. | 4 |
| 11 | Златогузка – Euproctis chrysorrhoea L | 29 |
| 12 | Сливовая плодожорка – Grapholitha funebrana Tr. | 3 |
| 13 | Восточная плодожорка – Gr. molesta Busck. | 10 |
| 14 | Листовертка изменчивая плодовая – Hedya nubiferana Haw. | 4 |
| 15 | Яблонная плодожорка – Laspeyresia pomonella L. | 14 |
| 16 | Грушевая плодожорка – Las. pyrivora Danil | 2 |
| 17 | Непарный шелкопряд – Lymantria dispar L. | 40 |
| 18 | Кольчатый шелкопряд – Malacosoma neustria L | 22 |
| 19 | Зимняя пяденица – Operophthera brumata L. | 9 |
| 20 | Античная волнянка – Orgya antiqua L. | 21 |
| 21 | Листовертка ивовая кривоусая – Pandemis heparana Den.& Sch. | 5 |
| 22 | Бледноногий вишневый пилильщик – Priophorus pallipes Lep. | 1 |
| 23 | Листовертка почковая – Spilonota ocellana F. | 11 |
| 24 | Яблонная горностаевая моль – Yponomeuta malinellus Zell. | 13 |
| 25 | Плодовая горностаевая моль – Y. padellus L. | 8 |
| Всего у американской белой бабочки | 89 | |
Наличие в местной фауне обширной группы энтомофагов, потенциально адаптированных к новому виду, является, как нам кажется, веским стимулом для принципиального изменения отношения к нему карантинной службы. К тому же следует напомнить, что еще ни один из обосновавшихся на территории России растительноядных карантинных видов насекомых не был полностью истреблен и в той или иной степени здесь распространился (Ижевский, 1997). С учетом этих обстоятельств стремление к полному уничтожению вредителя должно уступить место концепции, направленной на замедление темпов расширения его ареала из зоны первичного обоснования.
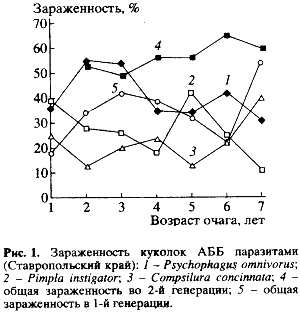
Анализ многолетних данных по зараженности АББ энтомофагами в Ставропольском крае свидетельствует о том, что многие виды паразитических насекомых (в основном широкие олигофаги) уже в первые годы после возникновения очагов существенно сокращают ее численность. Это массовые широко распространенные виды птеромалид, ихневмонид и тахин. Степень заражения ими нового вида-пришельца была высокой (рис. 1).
Высокий уровень заражения АББ паразитами уже в первые годы после появления в новом для него районе (зараженность куколок на второй генерации уже со второго года в ряде мест превышала 50%) (рис. 1) свидетельствует о способности местных паразитов существенно замедлять рост численности вида-пришельца. Такая картина наблюдалась в не нарушенных биоценозах (химические обработки против АББ здесь уже давно не проводятся, и видовой состав как фитофагов, так и энтомофагов весьма обширен (данные 1994 г)). Именно это, по нашему мнению, обеспечивает значительную естественную устойчивость к АББ биоценозов в Предгорном районе Ставропольского края и возможность их саморегуляции. Обитающие здесь паразитические и хищные виды насекомых быстро “включили в свой рацион” нового хозяина.
Наиболее заметна при этом была роль массовых доминантных видов паразитических насекомых-полифагов. Они имеют обширный набор хозяев, которые питаются разнообразными кормовыми растениями (табл. 2). Широкие пищевые связи позволяют таким видам поддерживать плотность собственных популяций на относительно стабильном уровне (во время депрессии численности какого-либо одного из хозяев они быстро переходят на питание другим). В результате активности аборигенных энтомофагов плотность популяции вида-пришельца на юге Ставропольского края после некоторого первоначального (в первые 2-3 года) повышения быстро сократилась (рис.2).
| Энтомофаг | Вредители (из Табл. 1) |
| Nabidae | |
| Himacerus apterus F. | 19,15,24 |
| Stalia major Costa | полифаг |
| Miridae | |
| Deraeocoris ruber L. | полифаг |
| Phytocoris ulmi L. | полифаг |
| Pentatomidae | |
| Arma custos F. | 4,7,14,17,18 |
| Pinthaeus sanguinipes F. | 9,17 |
| Troilus luridus F. | полифаг (17) |
| Chrysopidae | |
| Chrysopa carnea | 14,25 |
| Chrysopa septempunctata | ? |
| Tachinidae | |
| Compsilura concinnata Meig. | 4,9,11,17,18,20,25 |
| Exorista baranoff Wein. | ? |
| Exorista larvarum L. | 4,9,11,17,18,20 |
| Macquartias sp. | ? |
| Pales pavida | 11,17,18 |
| Trichogrammatidae | |
| Trichogramma cacoecia March. | 7,11,12,14 |
| Ichneumonidae | |
| Pimpla instigator F. | 4,7,8,9,11,14,17,18,19,20 |
| Pimpla turionella L. | 4,7,9,11,14,16,17,18,19,20,24,25 |
| Theronia atalantae Poda. | 4,11,14,17,18,20 |
| Virgichneumon dumeticola Craw. | ? |
| Pteromalidae | |
| Conomorium patulum Walk. | 10,18 |
| Psychophagus omnivorus Walker | 11,13,17 |
| Torymidae | |
| Monodontomerus aereus Walk. | 4,7,11,14,16,17,18 |
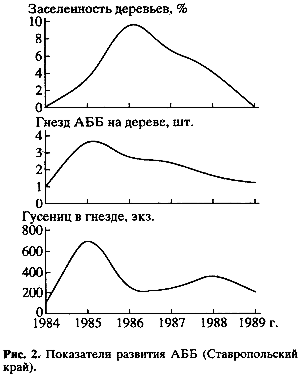
На восточной границе современного ареала АББ – в Нижнем Поволжье вид обосновывается в изначально мало устойчивых биоценозах с ограниченным набором кормовых растений и обедненными энтомокомплексами. Действие регулирующих факторов здесь ослаблено, и уровень плотности популяции адвентивного вида в первые годы после появления нестабилен.
Быстрое расширение ареала и увеличение плотности популяций АББ в этот период побуждало к использованию здесь радикального химического метода борьбы (этому, как указано выше, способствовали также карантинные правила и инструкции). Результаты подобных действий не только не способствовали ликвидации очагов АББ, но, напротив, провоцировали ускорение их разрастания, что соответствовало нашей рабочей гипотезе.
Для ее проверки были проведены исследования очагов АББ в садах Волгоградской области. Выбраны четыре экологически сходных района, различающиеся лишь по тактике проводимых против вредителя мероприятий: с ежегодными обработками химическими пестицидами (Светлый яр); с обработками бактериальными препаратами (Октябрьский р-н); с чередованием химических и микробиологических обработок (Аксайский р-н). Контролем являлись сады в Котельническом районе, где не проводили никаких обработок. В качестве критериев развития очагов выбрана динамика изменения их площади.
Как и ожидалось, изменение площади очагов определялось именно тактикой защитных мероприятий (рис. 3). При использовании пестицидов происходил равномерный рост очагов АББ (доля заселенных садов от всей их площади в районе). В результате, несмотря на ежегодные 3-5-кратные обработки сильнодействующими пестицидами (в том числе пиретроидами), не удавалось снизить темпы распространения адвентивного вида (Светлый Яр).
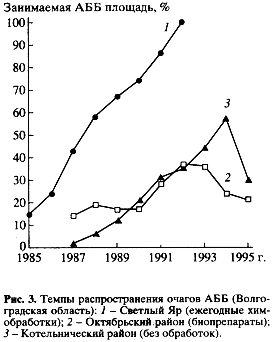
Совершенно иная картина была отмечена на участках, обрабатываемых биопрепаратами (в разные годы – дендробациллин, битоксибациллин, лепидоцид). Они, как известно, практически не оказывают воздействия на полезную фауну. В этом случае темпы увеличения площади очагов были замедленными (Октябрьский р-н). Быстрое прекращение здесь роста очагов позволило в течение ряда лет (1992-1994) даже полностью отказываться от обработок. В этом районе до сих пор свободными от АББ остаются около 80% садов. Подобный эффект в значительной мере был достигнут благодаря сохранению в агроценозах комплекса полезных насекомых, которые оказали стабилизирующее влияние на рост численности АББ. Несмотря на значительную обедненность энтомокомплексов (по сравнению с энтомокомплексами в Ставропольском крае), состав основных доминантных паразитических видов здесь был тот же. Определение уровня зараженности куколок АББ тахинами C. concinnata и E. larvarum показало, что при использовании бактериальных препаратов он был в 10 раз выше, чем в районе постоянных химобработок (соответственно 22 и 2%).
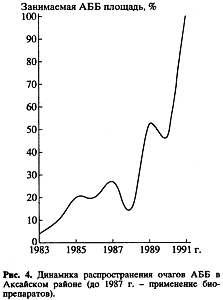
Полученные данные дают основание считать, что даже в обедненных биоценозах появление адвентивного вида не всегда должно сопровождаться немедленными широкомасштабными химическими обработками. Более того, химическое подавление естественных механизмов регуляции численности иногда может ускорить темпы распространения очагов или послужить толчком для этого. Подобная ситуация проиллюстрирована на рис. 4. В течение первых лет (до 1987 г.) в Аксайском районе очаги АББ в яблоневых садах обрабатывали исключительно биопрепаратами. Как и в Октябрьском районе, это способствовало определенной стабилизации очагов. Однако по ряду причин в последние годы в хозяйствах биологические препараты были заменены химическим. Применение последних тотчас же повлекло за собой резкое увеличение скорости распространения вредителя. Уже в 1991 г. все сады в районе оказались заселенными АББ.
В Котельническом районе борьба с АББ не проводилась. С момента появления ее здесь в 1987 г. площадь очагов медленно росла; к 1994 они заняли 57% площадей всех садов. В 1995 г. без всякого вмешательства со стороны службы защиты растений площадь очагов резко сократилась (рис. 4). Мы полагаем, что и в этом случае стал проявлять себя сохранившийся комплекс аборигенных энтомофагов. Адаптировавшись к виду-пришельцу, они стали активно воздействовать на его численность. Это предположение подтверждает высокая зараженность куколок тахинами; в 1995 г. она составляла здесь в среднем 16% (лишь немного ниже, чем в Ставропольском крае).
Выявленная зависимость динамики роста очагов АББ от тактики защиты садов проявляется и при сравнении плотности заселения деревьев вредителем. Наибольшее число гнезд с гусеницами на дерево отмечено в Светлом Яре – на фоне многолетних химических обработок.
1. Сохранение (благодаря отказу от применения пестицидов) видового разнообразия полезных насекомых в многолетних агроценозах позволяет аборигенным многоядным энтомофагам успешно противостоять нашествию чужеземного фитофага.
2. Переход доминантных паразитических видов-полифагов на нового хозяина может совершаться в первые же годы его появления при условии, если вид-пришелец по своим физиолого-биохимическим, экологическим и поведенческим особенностям сходен с какими-либо аборигенными видами, например с АББ.
3. В случае необходимости против адвентивного вида могут быть применены истребительные меры, однако лишь избирательного действия – например бактериальные препараты. Хотя, вероятно, при этом одновременно снижается и плотность популяции ряда аборигенных фитофагов, комплекс энтомофагов не претерпевает существенных изменений.
4. Применение против адвентивного (в нашем случае – еще и карантинного) фитофага химических средств (пестицидов) имеет лишь краткосрочный эффект и не только не оказывает стабилизирующего воздействия на популяцию вида-пришельца, но и провоцирует дальнейший рост его численности в результате массовой гибели полезных насекомых и их альтернативных хозяев (сокращение биоразнообразия).
5. Разработанная концепция применима и к другим карантинным (чужеземным) видам насекомых. Принятие предложенной концепции за основу при определении той или иной стратегии защиты растений от карантинных вредителей позволит сохранять и восстанавливать биологическое разнообразие природных энтомокомплексов, деградировавших в результате борьбы с адвентивными фитофагами.
| |
| Web-портал Чужеродные виды на территории России разработан и поддерживается кабинетом «Биоинформатики и моделирования биологических процессов» ИПЭЭ РАН. | |
| © 2004-. Кабинет "Биоинформатики и моделирования биологических процессов" ИПЭЭ РАН | |