Материалы Международного совещания [11..20]
Фауна мелких млекопитающих лесопарков г. Риги
Айо Б., Зоренко Т.
Биологический ф-т Латвийского университета, б. Kронвальда 4, Рига, LV-1586, zorenkot@lanet.lv
Работа посвящена изучению видового состава, демографической структуры и распределения мелких млекопитающих в лесопарковой зоне Риги. Лесопарки представляют геоботанически разнообразные, стабильные экосистемы города, которые занимают его незастроенную зону и непосредственно связаны с лесами, прилегающими к городу. Лесная зона составляет по площади 5018 га и разделена на четыре массива (Клейсти, Марупе, Межапарк и Бикерниеки). Межапарки включают в себя разные типы лесов и луговые биотопы.
На территории лесопарков (в течение трех осенних сезонов 1999-2000 и 2002 г.) ловушками Геро было отловлено 254 зверька и констатировано 8 видов. Доминирующим видом является рыжая лесная полевка (34,5%), ее содоминантом - полевая мышь (21, 2%). Третье место по встречаемости разделяют два вида: желтогорлая мышь (12,6%) и обыкновенная бурозубка (11,4%). В луговых биотопах лесопарков обитают обыкновенная (10,1%) и восточноевропейская (7,8%) полевки. Редкими видами являются малая лесная мышь (0,4%) и малая бурозубка (2%). Самый бедный видовой и численный состав отмечен в Межапарке (4 вида, доминирует желтогорлая мышь). Наибольшее разнообразие констатировано в Марупе - 6 видов (лишь здесь отловлена малая бурозубка), доминирует обыкновенная полевка. В Бикерниеки зафиксировано 5 видов, доминирует рыжая полевка. В Клейстах обнаружено 5 видов, доминирует полевая мышь. Различия доминирующих видов грызунов в разных лесопарках по-видимому объясняются их биотопическими различиями.
Анализ возраста отловленных животных показал, что осенью популяции разных видов в основном представлены молодыми животными, не достигшими половой зрелости. Небольшую долю составляют размножавшиеся самки и самцы весенней генерации. Половой состав близок 1:1 у рыжей полевки, небольшое преобладание самок отмечено у полевой,а самцов – у желтогорлой мыши.
Характеристика питания бурого медведя Якутии
Айыы Уола – Айан
Институт биологических проблем криолитозоны 677091, Республика Саха (Я) г. Якутск, пр. Ленина 41
Основу питания бурого медведя в Якутии составляют растительные корма 61,5%. Среди животных кормов преобладают млекопитающие (21,5%) беспозвоночные (13,8%). Птицы встречаются в небольшом количестве (3,2%). В годы исследований бурые медведи Якутии отдавали предпочтение также семенам кедра и кедрового стланика, ягодам брусники, голубики, шикши, толокнянки, смородины красной, малины, листьям и побегам ив, кроме того, корневищам и побегам зонтичных. Зеленые части растений (злаки, осоки, хвощи и пр.) присутствуют в содержимом желудка и экскрементах преимущественно весной и в первой половине лета. Из подземных генеративных органов растений чаще поедают корневища дягиля низбегающего. Побеги дягиля низбегающего активно поедаются во второй половине лета, а в остальных случаях - корневища. Встречаемость остатков насекомых (муравьев, ос, шмелей и другие) в поедях, экскрементах и желудках медведей Якутии довольно высока. При вскрытии добытого медведя обнаружилось, что его желудок на 60% был заполнен личинками короедов. Земноводные, рептилии и птицы (в основном, куриные), чаще являются случайным объектом охоты зверя. Из мелких млекопитающих обычным компонентом рациона чаще всего выступают грызуны: полевки, лесной лемминг, суслики, ондатра, бурундук и заяц-беляк, особенно в годы пика их численности. В редких случаях медведи могут поедать мелких хищников. Нами отмечены остатки американской норки в одном из желудков медведя, добытого в Южной Якутии. В бассейне р. Вилюй были обнаружены разрытые медведем две норы лисицы обыкновенной и экскременты зверя с остатками лис. Копытные по частоте встречаемости в пробах занимают третье место среди животных кормов после насекомых и грызунов. Медведями чаще всего поедаются остатки трупов копытных, погибших по разным причинам. В отдельных регионах часть особей специализируются на копытных, в том числе домашних. При весеннем учете бурого медведя в Верхоянье из 86 встреченных особей нами зарегистрировано 39 медведей-"хищников", которые, в отличие от других, выглядели намного упитаннее. Чаще всего жертвами хищника выступают северный олень, изюбрь, кабарга, косуля, реже лось и снежный баран.
Таежные элементы в териофауне северной лесостепи бассейна реки Дон
Александров В.Н.
Липецкий гос. педагогический университет
398020, г. Липецк, ул. Ленина, 42, klim@lspu.lipetsk.ru.
Территория Липецкой области расположена в северной части Центрально-Черноземного региона, на стыке Среднерусской возвышенности и Окско-Донской низменности. Фауна области соответствует ее общему ландшафтно-географическому положению северной лесостепи бассейна реки Дон. Несмотря на чрезвычайно высокую степень хозяйственного освоения территории, распаханность которой превышает 80%, а естественные биогеоценозы составляют всего 10%, териофауна относительно богата и разнообразна. Из общего числа видов наземных позвоночных животных – 353 (Недосекин, Климов, Сарычев, Александров, 1996), млекопитающих около 20%. Преобладают лесные элементы, заметное место занимают северные, в том числе таежные формы.
К числу местных, преимущественно редких и малочисленных видов относятся характерные и обычные для европейской тайги средняя бурозубка Sorex minutus, заяц-беляк Lepus timidus. Общие для северной лесостепи и таежной зоны - виды с широким ареалом: речная выдра Lutra lutra, ласка Mustela nivalis, горностай M. erminea, волк Canis lupus, лисица Vulpes vulpes, водяная полевка Arvicola terrestris, а обычные обитатели лесной зоны – лесная мышь Apodemus sylvaticus и обыкновенная белка Sciurus vulgaris. К числу распространенных местных видов относятся обитатели южной части тайги: лесная куница Martes martes, барсук Meles meles, речной бобр Castor fiber, ондатра Ondatra zibethicus и др. (Бобринский, 1967).
Островные леса, полезащитные и придорожные лесные посадки служат стациями на пути расселения млекопитающих в процессе взаимопроникновения фаунистических элементов. В предвоенные годы в задонские и усманские леса проникли из Рязанской области росомаха Gulo gulo, рысь Felis lynx, медведь Ursus arctos, кабан Sus scrofa и лось Alces alces. В составе териофауны Липецкой области закрепились два последних вида, остальные были убиты браконьерами (Барабаш-Никифоров, 1957).
Ископаемые лесные полевки Clethrionomys rufocanus и C. rutilus на юге Приморья
Алексеева Э.В.
426000, Удмуртская Республика, г. Ижевск, а/я 1391
Пещера-колодец “Близнец” находится в 25 км от г. Находка, на южном склоне хр. Чандалаз, на высоте 300 м над у. м. На северной стороне хребта произрастают темнохвойные и кедрово-широколиственные леса, на южном склоне – дубовые леса с зарослями леспедеции, у подножья – широкая сучанская долина с березовыми колками и ивняками. На глубине 3,0 м по С14 костей горала определена дата 11965±65 лет (СО АН – 1550). В гроте над пещерой имеются прилавки, которыми пользуются совы. В отложениях пещеры найдены несколько сотен тысяч костей амфибий, рептилий, птиц и млекопитающих. Из более чем 38 тыс. фрагментов черепов грызунов почти 29 тыс. (более 8 тыс. особей) принадлежат красно-серой полевке (КС) и 112 фрагментов от 67 особей – красной полевке (К). Черепа КС встречаются на глубине 6,3 – 0,2 м, а черепа К – на глубине 5,8 – 0,2 м. Имеются перерывы: костей КС нет в 4 малых интервалах, последний – на глубине 3,6 м; выше численность ее резко увеличивается. У К их 8, один метровый (1,9 – 1,0 м). Пики численности костей КС приходятся на глубины 1,7; 1,4 и 0,2 м, достигая 2,5 тыс. экз. в 0,1 м слое. У К выраженных пиков численности нет. Отмечено, что на глубинах 1,7 и 1,4 м численность костей большинства видов млекопитающих резко увеличивалась. Колебания численности полевок могут свидетельствовать об изменениях климата, растительности, скорости осадконакопления, а также о динамике численности хищников, в частности сов. Современные КС и К широко распространены на Дальнем Востоке. У ископаемых форм от нижних слоев к верхним наблюдается уменьшение размеров и четкая морфотипическая изменчивость зубов.
Кости мелких Mustelidae в пещере-колодце Близнец, Южный Сихотэ-Алинь
Алексеева Э.В.
426000, г. Ижевск, а/я 1391.
В толще глин от 7,5 до 0,3 м найдены 2130 фрагментов костей (КС) мелких куньих (МК), 1339 из них определены до вида. Размеры и строение КС древних МК отличаются от современных. Отмечено, что почти все кости МК принадлежат взрослым животным; в то же время треть КС барсука и др. – молодым. МК добывали ради ценной шкурки, а она становилась "выходной" только зимой. Прилавок грота над пещерой с давних времен служил охотникам убежищем. Соболь (С). Его КС составляют 16,4% от числа всех определенных. Глубина залегания (ГЗ) от 6,3 до 0,3 м. Пик относительной численности (ПЧ) на глубине 2,4-2,0 – 78,6%. Колонок (К), сходный с современным – 3,4%, ГЗ 2,6-0,4 м, ПЧ 1,4-1,0 м – 48,0%. Светлый хорь (СХ) и сходный с К – 73,1%, ГЗ 7,5-3,0 м, ПЧ 6,4-6,0 м – 90,3%. Кости их посткраниального скелета не разделены из-за отсутствия сравнительной коллекции. На нижней челюсти ископаемого СХ задняя линия углового отростка значительно выступает назад за заднюю линию венечного. Горностай (Г) – 5,4%, ГЗ 7,0-0,3 м, ПЧ 2,9-2,5 м – 29,8%. Ласка (Л) – 1,7%, ГЗ 5,4-1,0 м. Дольше других во времени существовал Г, толща породы с его костями – 6,7 м. На гл. 3,0 м исчезают кости СХ и сходного с К. На этой глубине по С14 костей горала определена дата 11965±65 лет (СО АН-1550). Одна из основных причин – изменение климата; вторая, возможно, конкуренция с С –- в слоях, где много СХ и сходного с К, кости С имеют "угнетенный" вид. Исчезновению их мог способствовать и антропогенный фактор. Близкий к югу Приморья современный СХ обитает в Китае и Амурской области. В древности он мог обитать на территории, ныне разделяющей их.
Территориальные отношения рыжих полевок и малых лесных мышей при рекреационных нарушениях лесов
Алпатов В.В., Жигарев И.А.
Московский педагогический гос. университет
129278 Москва, ул. Кибальчича, д. 6, к. 5 jigarev@orc.ru
Исследования проведены на северо-востоке Подмосковья VIII-IX 2001 г. Экологию грызунов изучали на 2-х лесных площадках по 4 га методом повторных поимок меченых зверьков в живоловки. Площадки отличались степенью рекреационной дигрессии. С целью выявления характера межвидовых территориальных отношений между численно доминирующими рыжими полевками и малыми лесными мышами был проведен полевой эксперимент. После установления размеров и распределения участков с площадок изъяли оседлое население рыжих полевок. Через 3 недели учеты повторили. После изъятия в рекреационном лесу плотность мышей возросла в 3,5 раза (с 2,55 до 9,18 ос/га), а в ненарушенном лесу практически не изменилась (11,47 и 10,39 ос/га). Такая же динамика характерна и для доли мышей в населении грызунов (в рекреации она возросла с 0,27 до 0,54, в ненарушенном лесу не изменилась: 0,36–0,36). В рекреационном лесу после изъятия индекс перекрывания участков полевок с мышами (среднее количество перекрываний участков мышей с одним участком полевки) резко возрос с 0,41 до 1,28 (отличия достоверны, p=0,003). В контроле он достоверно не изменился, имея тенденцию к некоторому снижению (с 1,17 до 0,84). Т. о., изменения параметров среды лесного биоценоза, вызванные рекреацией (см. Казанская и др., 1977; Жигарев, 1993 и др.) вызывают изменения в характере и стабильности территориального распределения грызунов. Объяснить это можно изменением уровня конкурентного взаимодействия двух видов: в ненарушенном лесу он низкий (ресурсы, в том числе территориальные, по крайней мере, в это время года разделены, либо избыточны); в рекреации он высокий, при этом полевки сдерживают расселение мышей. Работа поддержана грантом РФФИ-Подмосковье 01-04-97014 и Университеты России УР.07.01.018.
Распознавание представителей своего и близкородственного видов по обонятельным сигналам у двух видов домовых мышей.
Амбарян А.В., Котенкова Е.В.
Институт проблем экологии и эволюции им. А.Н. Северцова РАН 119071 Москва, Ленинский проспект, 33, sevin@orc.ru
В лабораторных экспериментах изучали реакцию представителей двух видов мышей Mus musculus и M. spicilegus на запах мочи особей своего по сравнению с близкородственным видом. В качестве источников запаха использовались пробирки с мочой самок и самцов этих видов. В 10 минутных опытах с помощью фотоэлементов фиксировали время нахождения мыши в четырех отсеках камеры-ольфактометра, содержащих пробирки с мочой. В каждом опыте зверькам одновременно предъявляли четыре источника запаха: самцов и самок двух этих видов. Показано, что суммарное время нахождения в отсеках с запахом мочи самцов и самок своего и близкородственного видов достоверно различалось как у представителей M. musculus (p<0.05 для самцов и p<0.02 для самок), так и M. spicilegus (p<0.01 для всех особей). Самки и самцы M. musculus достоверно дольше находились в отсеке с запахом мочи самки своего вида по сравнению с запахом самки M. spicilegus (р<0.001 для самок, р<0.02 для самцов). В то же время не найдено достоверных отличий во времени нахождения в отсеках с запахом самцов обоих видов. Напротив, для всех особей M. spicilegus (при суммарной обработке результатов для самцов и самок) было характерно предпочтение отсека с запахом самца своего вида по сравнению с близкородственным (р<0.001), хотя для самок в отдельности эти различия не были достоверны (р>0.05). У M. musculus и M. spicilegus (при суммарной обработке результатов для самцов и самок) не обнаружено достоверных различий во времени нахождения в отсеках с запахом самок. Полученные данные подтверждают способность представителей этих видов мышей различать обонятельные сигналы особей своего и близкородственного видов. В другой серии опытов показано, что представители двух видов M. musculus и M. spicilegus достоверно дольше исследуют запах мочи особей своего вида по сравнению с близкородственным при разведении образцов мочи от 1:5 до 1:65. Поддержано РФФИ, грант 01-04-48283.
Взаимосвязь иммунитета и социального статуса самцов полевой мыши Apodemus agrarius
Андреевских А.В., Кравченко Л.Б.
Томский гос. университет 634050, г. Томск, пр. Ленина, 36, zoo@bio.tsu.ru
Иерархический статус особи играет большую роль в жизни грызунов и влияет на размер индивидуального участка, на возможность оставить потомство и в целом на выживаемость индивидуума. Агрессивность самцов зависит от продукции половых гормонов, которые в свою очередь обладают иммуносупрессивным эффектом. Однако это влияние далеко не однозначно.
Отлов проводился в городской и пригородной зоне города Томска (n=45). Агрессивность самцов в ситуации территориального конфликта оценивалось в тесте попарного ссаживания. Животные были разделены на три группы: доминанты, субдоминанты и субординанты. Субординанты в обеих популяциях имели равные и очень низкие значения этого показателя, а зверьки с более высоким социальным статусом (субдоминанты и доминанты) достоверно различались по уровню агрессивности (соответственно U=0; p<0,01 и U=0; p<0,05). Степень агрессивности самцов, обитающих в пригороде, достоверно превышала этот показатель у животных соответствующих социальных групп из города. В городском парке, где полевые мыши отличаются повышенной исследовательской активностью, подвижностью и сниженной агрессивностью, доминанты по сравнению с низкоранговыми особями имели минимальный иммунный ответ. В то же время в южном пригороде, в условиях многовидового сообщества, группа доминантов характеризовалась более высокой иммунорезистентностью по сравнению с другими группами. Доминантные особи из этого биотопа отличались от доминантов города большими значениями гуморального иммунного ответа (U=0; p=0,05) и большей агрессивностью(U=0; p=0,05). Т. о., в зависимости от абиотических и биотических условий среды, отношение между иммунными и иерархическими статусами особей могут приобретать противоположный характер. Работа выполнена при поддержке научной программы МО РФ «Университеты России» (УР.07.01.036)
Паразиты мелких млекопитающих Кандалакшского заповедника
Аниканова В.С. 1, Бойко Н.С. 2, Беспятова Л.А. 1, Бугмырин С.В. 1
1Институт биологии КарНЦ РАН, 185610 Петрозаводск, Пушкинская, 11, anikanova@krc.karelia.ru
2Кандалакшский гос. природный заповедник, 184040 Кандалакша, Мурманская обл., ул. Линейная, 35, boyko@nm.ru
Исследования проведены на материковой части Кандалакшского государственного природного заповедника – Карельском берегу во второй декаде сентября 1999 – 2000 гг. Всего обследован 121 зверек. Из них бурозубок - 94 экз. (Sorex araneus - 50 экз, S. minutus - 27, S. caecutiens –17), мышевидных грызунов – 27 экз. (Clethrionomys glareolus Schreb - 19, C. rufocanus Sund –2, Microtus agrestis - 5 и Microtus oeconomus P. -1).
Паразиты бурозубок (18 видов) представлены трематодами – Brachylaemus fulvus, Neogliphe sobolevi, Rubenstrema exasperatum, цестодами – Hymenolepis scutigera, Ditestolepis diaphana, D. secunda, Neoskrjabinolepis singularis, Staphylocystis furcata, Dilepis undula, Molluscotaenia crassiscolex, нематодами – Capillaria kutori, Eucoleus oesophagicola, Longistriata codrus, didas, depressa, Porrocaecum depressum, гамазовыми клещами – Hirstionyssus eusoricis и Laelaps hilaris. У мышевидных грызунов выявлено 16 видов паразитов. Среди них цестоды –Catenotaenia pussila, Paranoplocephala omphalodes, Aprostatandrya sp., нематоды – Heligmosomoides glareoli Syphacia sp., гамазовые клещи hilaris, Hyperlaelaps arvalis, Hi. isabellinus, Pergamasus crassipes, Euryparasitus emarginatus, Cyrtolaelaps mucronatus и блохи Ctenophthalmus uncinatus, Rhadinopsylla integella, Megabothris rectangulatus, Amphipsylla sibirica, Amalaraeus penicilliger.
Проведенные исследования показали, что фауна паразитов мелких млекопитающих представлена специфичными для их хозяев видами. Выявлено обеднение видового состава паразитов мелких млекопитающих, обитающих на периферии их ареалов.
Особенности формирования гельминтоценоза европейской норки на севере Беларуси и России в связи с экспансией американской норки
Анисимова Е.И., ** Качановский В.А, ** Качановская П.Д.
Ин-т зоологии НАН Беларуси, г. Минск
**Центрально- лесной заповедник, Россия
К настоящему времени европейская норка (Mustela lutreola) является почти исчезнувшим видом фауны в пределах прежнего ареала. Гипотезы ее исчезновения различны. Паразиты - достаточно весомый рычаг воздействия на популяцию и в экстремальных ситуациях в совокупности с воздействием других неблагоприятных факторов способны ухудшить демографическое состояние популяции (снизить темпы размножения или увеличить смертность вида). Изучена зараженность и видовое богатство гельминтов европейской норки северо-востока Беларуси и России в периоды различной плотности популяций интродуцированной американской норки. Выявлены существенные изменения в составе гельминтов европейской норки в связи с различными факторами: пространственное распределение ассамблеи куньих, особенности пространственно-этологической структуры их популяций; характер пространственного распределения жертв, смена обычных мест обитания. В результате воздействия экспансивных популяций американской норки (Mustela vison), произошло физическое изгнание европейской норки из наиболее благоприятных мест обитания. В результате появились новые для данного хозяина виды гельминтов. Изучены патогенные для европейской норки виды гельминтов.
Новые точки находок 40-хромосомных и 28-хромосомных белозубок р.Crocidura (Insectivora) на юго-востоке Русской равнины
Анискин В.М., Ковальская Ю.М., Богомолов П.Л., Лебедев В.С.
Институт проблем экологии и эволюции РАН 119071, Москва, Ленинский пр., 33
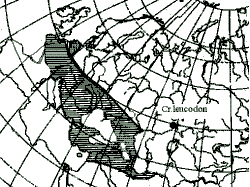 Исследованы кариотипы 13 экз. белозубок р. Crocidura из 7 пунктов юго-востока Русской равнины: Волгоградская обл., оз. Эльтон (3 экз.) и Чернышковский р-н, Цимлянские пески (1 самка); Астраханская обл., Ахтубинский р-н, гора Богдо (4 экз.), Ростовская обл., Цимлянский р-н, Цимлянские пески (1 самка и 1 самец) и Сальский р-н, пос. Гигант (1 самка); Оренбургская обл., Первомайский р-н , 2 км к востоку от с. Курлин (1 самка) и р. Шаган, хут. Шапошникова (1 самка). Кариотипы 11 белозубок из первых 5 пунктов одинаковы, диплоидное число хромосом равно 40, число плеч хромоcом (NF) – 50. В наборе отмечено 4 пары двуплечих и 15 пар одноплечих аутосом. Х-хромосома – средний по величине субметацентрик, Y-хромосома – акроцентрик. По структуре кариотипа эти зверьки не отличаются от кариотипа малой белозубки C. suaveolens из многих других географических пунктов широкого ареала этого вида. Иное строение хромосомного набора обнаружено нами у белозубок, пойманных в 2 пунктах Первомайского р-на Оренбургской обл. У обеих кариологически исследо-ванных самок все хромосомы двуплечие, 2n=28, NF=56. Кариотипы такого строения были выявлены другими исследователями (Reumer, Meylan,1986, Графодатский и др.,1988) из нескольких географически удаленных пунктов ареала белобрюхой белозубки C. leucodon от Западной Европы до Закавказья и Турции. Кариологически подтвержденную находку белозубок группы leucodon на южной окраине Общего Сырта пока следует считать самым восточным пунктом ареала этой группы (см.карту из Зайцева, 1993 с нашей точкой).
Исследованы кариотипы 13 экз. белозубок р. Crocidura из 7 пунктов юго-востока Русской равнины: Волгоградская обл., оз. Эльтон (3 экз.) и Чернышковский р-н, Цимлянские пески (1 самка); Астраханская обл., Ахтубинский р-н, гора Богдо (4 экз.), Ростовская обл., Цимлянский р-н, Цимлянские пески (1 самка и 1 самец) и Сальский р-н, пос. Гигант (1 самка); Оренбургская обл., Первомайский р-н , 2 км к востоку от с. Курлин (1 самка) и р. Шаган, хут. Шапошникова (1 самка). Кариотипы 11 белозубок из первых 5 пунктов одинаковы, диплоидное число хромосом равно 40, число плеч хромоcом (NF) – 50. В наборе отмечено 4 пары двуплечих и 15 пар одноплечих аутосом. Х-хромосома – средний по величине субметацентрик, Y-хромосома – акроцентрик. По структуре кариотипа эти зверьки не отличаются от кариотипа малой белозубки C. suaveolens из многих других географических пунктов широкого ареала этого вида. Иное строение хромосомного набора обнаружено нами у белозубок, пойманных в 2 пунктах Первомайского р-на Оренбургской обл. У обеих кариологически исследо-ванных самок все хромосомы двуплечие, 2n=28, NF=56. Кариотипы такого строения были выявлены другими исследователями (Reumer, Meylan,1986, Графодатский и др.,1988) из нескольких географически удаленных пунктов ареала белобрюхой белозубки C. leucodon от Западной Европы до Закавказья и Турции. Кариологически подтвержденную находку белозубок группы leucodon на южной окраине Общего Сырта пока следует считать самым восточным пунктом ареала этой группы (см.карту из Зайцева, 1993 с нашей точкой).
Изменчивость кариотипа темной мышовки Sicista severtzovi severtzovi (Rodentia): К проблеме сохранения генофонда малых популяций
Анискин В.М., Горелов Ю.К., Ковальская Ю.М., Шаповалов А.С.
Институт проблем экологии и эволюции РАН, 119071, Москва
Государственный заповедник “Белогорье”
В настоящем сообщении изложены предварительные результаты сравнительного анализа хромосомных наборов мышовок Sicista severtzovi severtzovi из 5 пунктов ареала этого подвида. Приведены оригинальные сведения о кариотипах мышовок из Белгородской обл.: 1) р. Оскол, Ямская степь –1 ♂ с 2n=20, NF=28, 2 ♂♂ с 2n=21, NF=29 и 2) р. Айдар, окр. с. Ровеньки – 1 ♂, 1 ♀ с 2n=16, NF=28. Данные о кариотипе ещё одного зверька из этого же пункта, но с другим числом хромосом - 2n=18, NF=28, опубликованы нами ранее (Опарин и др., 2001). Известно, что в Курской обл. (Центрально-Черноземный гос. зап.) обитают темные мышовки с 2n=18-20, NF=28-30 (исследовано 6 экз.) (Соколов и др., 1986), в Воронежской обл., около г. Богучар пойман самец того же вида с 2n=18, NF=28 (Ковальская и др., 2000), а на Украине (Стрельцовская степь Луганского зап.) в кариотипе исследованных мышовок отмечено18 (17) хромосом, но не указано число исследованных зверьков (Zagorodnyuk, Kondratenko, 2000). Сопоставляя все известные материалы по кариологии номинативного подвида темной мышовки, можно считать установленным, что в 4 из 5 исследованных пунктах наблюдается хромосомный полиморфизм. Всего отмечено 3 структурные мутации: 1 тандемная транслокация, уже рассмотренная в одной из предыдущих публикаций, и 2 робертсоновские транслокации, выявленные у мышовок этого вида впервые. Показано, что внутрипопуляционный полиморфизм в каждой из 3 выборок (с числом исследованных экземпляров не менее 3) ограничен 1 хромосомной перестройкой, а межпопуляционные различия кариотипов обусловлены 1 или 2 структурными мутациями. В настоящее время при высокой хозяйственной освоенности лесостепной черноземной полосы отдельные, фактически островные популяции S. severtzovi сохраняются на небольших заповедных участках или сельскохозяйственных неудобьях. Такая абсолютная или частичная изоляция способствует дрейфу генов, сохранению и развитию межпопуляционных различий, причем утрата своеобразной в хромосомном отношении популяции может привести к обеднению генофонда вида. В Национальной Стратегии сохранения биоразнообразия России (2001) эта проблема упомянута в одной фразе.
Выдра Lutra lutra в бассейне реки Вытебети
Антоневич А.Л., Эрнандес-Бланко Х.А
Биологический ф-т Московского Государственного Университета 119992, Москва, Ленинские горы, ant_nas82@mail.ru
Целью исследования являлось установление присутствия выдры на различных водоемах в бассейне р. Вытебеть от национального парка «Орловское полесье» до ее впадения в р. Жиздра (приток р. Ока). Задачи включали в себя анализ распределения следов жизнедеятельности выдры. Работа проводилась с июня 2000 г. по август 2002 г. методами тропления, картирования следов жизнедеятельности, измерения отпечатков конечностей. Помимо общего картирования следов жизнедеятельности выдр был выяснен характер размещения меток (экскрементов и поскребов) по берегам исследованных водоемов. Различные следы жизнедеятельности выдр, свидетельствующие о присутствии животных, были зафиксированы во всех исследованных водоемах. Следы присутствия выдры отмечаются практически на всем протяжении р. Вытебеть, частота их встречаемости на разных ее участках различна. Проведен анализ распределения экскрементов, являющихся в комплексе с поскребами маркерами занятости участка обитания, который показал, что как на р. Вытебеть, так и на ее притоках распределение меток носит неравномерный и неслучайный характер. Собранные данные позволяют сделать вывод о достаточно высокой плотности выдры на этих водоемах. Выявлена разная степень использования притоков Вытебети выдрами. Максимальная плотность этого вида отмечалась на территории национального парка «Орловское полесье» и на участке реки между охранными зонами национального парка и заповедника «Калужские засеки». В апреле 2002 г. были отмечены следы самки с детенышем, что свидетельствует о размножении выдры на территории заповедника.
Участок полного отсутствия каких-либо следов пребывания выдры на р. Вытебеть совпадает с местами наибольшего антропогенного вмешательства
Речной бобр Castor fiber на Днепропетровщине
Антонец Н.В.
Днепровско-Орельский природный заповедник
49108, Украина, Днепропетровск, ул. Ашхабадская 15 zapoved@ff.dsu.dp.ua
В списках териофауны Днепропетровской обл. отсутствует речной бобр (Булахов и др., 1983; 1984; 1990). По данным (Булахов, Губкин, Рева, 1996) и (Рева, 2001) “…речной бобр – аутакклиматизированный c 1992 г. отмечается только в Днепровско-Орельском зап. (пойменные дубравы) в связи с созданием каскада водохранилищ на Днепре и организацией заповедного режима в их верховьях“, что не соответствует действительности. В настоящее время речной бобр – редкий аборигенный вид пойменных комплексов р. Днепр (Антонец, 1998; 1998а; Антонець, 2000; 2001) и его притоков (Антонец, Водяной, 1999). За пределами заповедника бобры обитают в пойме р. Домоткань (правобережный приток р. Днепр) вблизи с. Заречье Верхнеднепровского р-на. Здесь живет две семьи бобров – ок. 10 ос. и рекомендовано создать комплексный заказник “Домоткань” на участке лесо-луговой поймы от устья до с. Акимовка общей площадью до 200 га. Раньше бобры обитали вблизи с. Красное на правом берегу Днепродзержинского вдхр. Поселения бобров установлены на левобережье Днепра вблизи лодочной станции “Зозуля” Самарского района (существует с 2000 г.; численность - 10 ос. по учетам на 2002 г.; рекомендовано создать заказник) и вблизи устья р. Орель (старое русло) на левобережье Днепродзержинского вдхр. Петриковского р-на (Чегорка, Манюк и др., 2000). Обследование последнего поселения бобров в 2002 г. показало, что тут обитает несколько семей бобров (около 20 ос.). В 70-х годах егерь Шульговского л-ва Петриковского лесхоза, Полєно И.А. осуществил выпуск 6 бобров (4 ♀♀ и 2 ♂♂) в урочище Штанцы на пойменную старицу р. Орель из р. Ворскла Миргородского р-на Полтавской обл. Поселение бобров расположено на территории вновь созданного национального парка “Орельский”. Абсолютная численность речного бобра в заповеднике невысокая и на протяжении 1992 – 2002 гг. она возрастала с 5 до 15 ос. соответственно. В Днепропетровской обл. на Днепре и его притоках существует южная маргинальная популяция речного бобра, которая состоит из 4-х обособленных поселений с общей численностью около 55 ос.
Восточноевропейская полевка Microtus rossiaemeridionalis Днепровско-Орельского заповедника
Антонец Н.В., Окулова Н.М.
Днепровско-Орельский природный заповедник (Украина)
Институт проблем экологии и эволюции им. А.Н. Северцова (Россия) 49108, Украина, Днепропетровск, ул. Ашхабадская 15 zapoved@ff.dsu.dp.ua
Инвентаризация и мониторинговые исследования мелких млекопитающих заповедника проводились с 1991-2002 гг. (отработано 38050 л./сут. и отловлено 3075 ос. микромаммалий 15 видов). Специалисты ДНУ и НИИ биологии ДНУ не проводили ревизию видового состава микромаммалий Днепропетровской обл. современными методами диагностики. В списках фауны отсутствуют такие виды, как мышь малая лесная Sylvaemus uralensis и полевка восточноевропейская (Булахов и др., 1984; 1990) и приведена полевка обыкновенная Microtus arvalis, юго-восточная граница распространения которой на Украине проходит на територии республики вдоль линии Одесcа - Кировоград - Черкассы - Прилуки - Сумы (Тесленко, Загороднюк, 1986) и далее на восток встречается только восточноевропейская полевка, что и было подтверждено совместными с проф., Н.М. Окуловой исследованиями (1998-2000 гг.) в угодьях заповедника (L - 102,53±1,7; Са -37,82±1,3; Au - 10,65±0,9; Рl - 15,84±0,6; Р - 28,81±2,5; п=79). Размах колебаний (n=79): L max - 122 мм и L min - 82 мм; Са max - 50 мм и Са min - 25 мм; Au max - 13 мм и Au min - 7 мм; Pl max - 17 мм и Pl min - 14 мм; P max - 47,8 г и Р min - 19,2 г. Индексы составили: Ca/L - 0,369; Au/L - 0,104; Pl/L - 0,154; P/L -0,281. Среднее многолетнее соотношение самцов к самкам в популяции составило (54:71) или 1:1,31, т.е. преобладают самки. Количество эмбрионов у исследованных самок (п=26) колебалось от одного до шести и составило соответственно: 1 - 3,85%; 2 - 3,85%; 3 - 23,07%; 4 - 38,46%; 5 - 19,23%; 6 -11,54%. Это эвритопный вид, населяющий как пойму так и песчаную степь.
К познанию биологического сигнального поля уссурийского кабана
Антонов А.Л.
Институт водных и экологических проблем ДВО РАН
680000 г. Хабаровск, ул. Ким Ю Чена, 65, antonov@ivep.khv.ru
В период с 1982 по 2002 гг. исследовали элементы биологического сигнального поля (БСП) кабана на юго-востоке Приамурья. Основная часть исследований выполнена на мониторинговом участке в бассейне верхнего течения р. Шивки, притока р. Уссури на площади 5,5 тыс. га. Плотность населения в период исследований колебалась от 0 до 5,5 ос/1000 га. Выделены следующие основные элементы БСП кабана на юге Приамурья: "почески", "купалки", "гайна" (табл.).
Таблица. Распределение основных элементов БСП кабана на юге Приамурья
| Стация | Длина мар-шрута, км | "Купалки" | "Почески" | "Гайна" |
| Кедрово-широкол. лес | 311 | 14 (11)* | 34 (29) | 38 |
| Елово-пихтовый лес | 91 | 7 (3) | 16 (4) | 11 |
| Прирусловой лес | 72 | 5 (0) | 7 (0) | 14 |
| Широколиств. лес | 16 | 4 (0) | 7 (0) | 4 |
| Дубняк | 17 | 0 (0) | 0 (0) | 3 |
| Вырубки в кедрово-широколиственном лесу | 9,5 | 3 (0) | 5 (1) | 3 |
| Мелколиственный лес | 18 | 4 (0) | 6 (0) | 1 |
Среди этих элементов БСП важное информационное значение имеют постоянные (многолетние) "почески", которые встречаются, в основном, в малонарушенных участках кедрово-широколиственного леса. Для них всегда используются хвойные деревья, в основном, кедр (82% всех постоянных почесок, n=34). Они часто удалены от "купалок" и вообще от воды, обычно располагаются на водораздельных гребнях. В период, предшествующий гону и во время него задиры на таких деревьях обновляются.
О зимовке гладконосых летучих мышей (Mammalia, Chiroptera) в Якутии
Ануфриев А.И.
Институт биологических проблем криолитозоны СО РАН, г. Якутск
677891 Республика Саха (Якутия), г. Якутск, пр. Ленина 41.
Летучие мыши, обитающие на Северо-востоке России, до сих пор остаются в группе недостаточно изученных видов животных. О годичном цикле их жизнедеятельности в Якутии, перезимовке и миграциях мы можем говорить лишь в предположительной форме. Сведения о зимовке гладконосых летучих мышей в Якутии ограничиваются двумя фактами, в книге палеонтолога Русанова (1976), сообщается о нахождении живых летучих мышей в пещере в окрестностях пос. Хатыстыр, расположенного к западу от г. Алдана, (580 50' с.ш. и 1250 10' в.д.) видовой состав не определен. В 1987 году, зимовка рукокрылых обнаружена при обследовании заброшенной части гипсового рудника «Олекминский» (600 25' с.ш., 1200 30' в.д.) (Ревин, Боескоров, 1989). В мае 2001 г. на руднике «Олекминский» рабочими рудника, по нашей просьбе, были отловлены 6 экз. летучих мышей. Из которых 2 – бурый ушан, 4 – северный кожанок. В 2002 продолжено изучение экологии и биологии гладконосых летучих мышей в Якутии. При посещении рудника «Олекминский» 12-14 ноября 2002 г. на маршруте протяженностью около 1,5 км, обнаружены 16 летучих мышей – живых, и одна погибшая и полностью истлевшая особь. Из 17 штук 10 – бурые ушаны Plecotus auritus, остальные – северные кожанки Eptesicus nilssony. При экспериментальном исследовании перезимовки летучих мышей, в лабораторном помещении созданы условия, близкие к естественными. Животные содержатся в темноте, температуры среды, как и в природе, на уровне 00-30С. Часть животных ежесуточно взвешивается, остальные находятся под непрерывным наблюдением за периодикой процессов зимней спячки. Зимняя спячка у рукокрылых, зимующих в Якутии, начинается в конце сентября и завершается в конце апреля, и включает периоды гипотермии, чередующиеся с интервалами активного состояния, периоды гипотермии при температуре среды 10 – 20С от 5 до 11 суток, продолжительность пробуждения, нормотермии, остывания не более 4-6 часов. Потери массы составляют в среднем у 7 зверьков (0,0348 ± 0,0049) г/жив. в сутки или 0,185 мг/г.час.
Исследования поддержаны грантом РФФИ № 01-04-4971
Классификация почв участков норения белого песца в восточноевропейских тундрах
Ануфриев В.В.
АО «Нордэко Евразия». 163000, Архангельск, проспект Ломоносова, 206, офис 210, anufriev@nordeura.arh.ru
В 1988-94 годах исследовались почвы в местах расположения выводковых нор песца в северной части Большеземельской тундры и Югорского полуострова. Обследовано 38 нор зверей в Большеземельской тундре и 20 - на Югорском п-ове. Классификация почв участков размещения нор песца проведена на основе "Классификации почв СССР" (1977). В Большеземельской тундре норы зверей располагались в 8 типах почв: тундровых криогенно-глеевых в комплексе тундровыми иллювиально-гумусовыми торфяными (2% всех нор), тундровых криогенно-глеевых остаточных (пятен) в комплексе с тундровыми иллювиально-гумусовыми торфянистыми (24%), тундровых криогенно-глеевых торфяных в комплексе с болотно-тундровыми криогенно-глеевыми торфянистыми (12%), болотно-тундровых криогенно-глеевых торфяных (6%), болотно-тундровых криогенно-глеевых торфянистых (18%), аллювиальных криогенных иловато-глеевых (29%), аллювиальных примитивных в комплексе с аллювиальными болотными (9%). На Югорском полуострове норы зверей располагались в 4 типах почв: тундровых криогенно-глеевых в комплексе тундровыми иллювиально-гумусовыми торфяными (14% всех нор), болотно-тундровых криогенно-глеевых торфянистых (43%), аллювиальных криогенных иловато-глеевых (14%), аллювиальных примитивных в комплексе с аллювиальными болотными (29%).
Активность изюбря Cervus elaphus xanthopygos на природных солонцах Сихотэ-Алиня
Арамилев В.В.
Тихоокеанский институт географии ДВО РАН
690041 Приморский край, г.Владивосток, ул.Радио д.7, isunr@online.marine.su
Для изучения использования природных солонцов изюбрами на естественном солонце в Центральном Сихотэ-Алине были закреплены радиометки системы Норка-1 (ВНИИОЗ) на изюбрях разного пола и возраста: ♂ 2 года (26 мая); ♀ 2-3 года (30 мая); ♂ 4-5 лет, (11 июня); ♂ 1 год (28 июля); ♀ с теленком, 4-5 лет(5 августа); ошейником с номером была помечена ♀ с теленком, 4-5 лет(14 августа). Иммобилизация изюбрей осуществлялась пулями Комарова по его методике для благородного оленя, адаптированной нами для изюбря в условиях горной системы Сихотэ-Алинь. С помощью радиометок отслеживалась частота посещения изюбрями солонцовых урочищ, суточная активность и перемещения животных. По данным радиопеленгаций, периоды нахождения изюбра в одной точке без перемещений в весенне-летний период продолжается от 10 м. до 3 ч. 10 м. В среднем за сутки периоды нахождения в одной точке продолжаются от 6 ч. 30 м. до 9 ч. 40 м. При этом за сутки изюбр не перемещается 1 - 2 раза в течение 1,5 - 2,0 ч. и 8 - 12 раз в течение 10 - 30 м. Существуют и индивидуальные отличия в суточной активности изюбров. Изюбрь № 4 во всех случаях не перемещался с 17 до 18 ч., в то время как изюбрь № 2 был в одной точке с 7 до 8 ч. утра и перемещался с 2 до 3, с 6 до 7 и с 12 до 13 ч. По данным пеленгаций изюбрей в летний период можно выделить четыре пика перемещений за сутки, приходящихся на 4 - 7, 10 - 12, 19 - 20 и 23 - 1 час. В течение одного солонцового периода помеченные изюбры фиксировались на солонцах урочища от 1 до 10 раз. Продолжительность пребывания изюбров в солонцовом урочище составила от 12 до 25 ч. Ни один из помеченных изюбров не обитал в солонцовом урочище постоянно, поэтому каждый визит в урочище с приближением к солонцам мы считали посещением солонцов. Удалось отследить перемещение изюбря к солонцу и обратно. В течение первых трех суток изюбрь держался на одном месте, перемещаясь в радиусе 1,5-2,0 км. На четвертые сутки изюбр стал медленно приближаться к солонцовому урочищу, где и провел почти все последующие сутки. К исходу пятых суток изюбрь переместился к месту своего предыдущего пребывания, где и оставался в последующие сутки. Из помеченных изюбров чаще других посещал солонцы ♂ № 2, помеченный 26 мая: он был запеленгован в районе солонцов с 26 по 28 мая, с 6 по 11 июня, 13 июня, 30 июля и визуально наблюдался на солонце 20 мая следующего года. ♂ № 4 был помечен 28 июля и посетил солонцовое урочище 9 сентября. В мае следующего года он был запеленгован в солонцовом урочище 10-11 мая, и 17-19 мая. ♀ № 10, помеченная 30 мая, посетила солонцовое урочище только 12 сентября, а ♀ № 9 с теленком, помеченная 5 августа, - только 15 мая следующего года. ♀ с теленком, помеченная ошейником с номером 14 августа была визуально зафиксирована на солонце вместе со своей подросшей дочерью 24 мая следующего года. ♂ № 1, время мечения - 11 июня, 11 августа был запеленгован в 1 км от солонцового урочища, что позволяет предположить посещение солонцов, т. к. все предыдущее и последующее время он держался в 7 - 15 км от солонцового урочища. Проведенная нами работа и анализ опубликованных на эту тему материалов показывает, что посещение и использование природных солонцов - неотъемлемая часть жизненного цикла изюбров в горных ландшафтах, где в кормах копытных недостаточно натрия.
Современное состояние териофауны Республики Татарстан (РТ)
Аськеев И.В., Аськеев О.В., Беляев А.Н.
Институт экологии природных систем АН РТ
420087, Татарстан, Казань, Даурская 28; skeyev@iens.kcn.ru
Проведенная ревизия териофауны показала, что на территории республики (с начала н.э. до 21 века) были отмечены 91 вид млекопитающих, из которых постоянно встречается и размножается 72 вида; 9 видов - заходят и отмечаются их единичные встречи; 10 видов исчезли: степная пищуха, узкочерепная полевка, желтая пеструшка, черная крыса, соболь, росомаха, северный олень, сайга, кулан, тарпан. Реально нахождение еще 9 видов млекопитающих. Т. о., число видов может достигнуть 100. Акклиматизированы - ондатра, енотовидная собака и американская норка, белка-телеутка. Реакклиматизированы - речной бобр, кабан. За последние 30 лет, найдены 6 видов млекопитающих ранее не наблюдавшиеся: нетопырь-карлик, каменная куница, ушастый еж, малая белозубка и равнозубая бурозубка, тундровая бурозубка. В последние двадцать лет нет достоверных находок: выхухоли, крошечной бурозубки, орешниковой и садовой сонь, степной мышевки, хомячка Эверсманна, темной и красной полевок, корсака, колонка, европейской норки. Териофауна РТ богата видами и достаточно разнообразна (см. табл.). Отмечены представители 7 отрядов и 19 семейств. Наиболее представительны семейства: хомяковых (13 видов), обыкновенных летучих мышей (12 видов), куньих (11 видов), землеройковых (8 видов).
| Отряды | ВВ | ПВР | З | И | ВП | АК |
| Насекомоядные | 13 | 12 | 1 | - | 1 | - |
| Рукокрылые | 12 | 7 | 5 | - | 2 | - |
| Зайцеобразные | 3 | 2 | - | 1 | - | - |
| Грызуны | 36 | 33 | - | 3 | 6 | 1 вид и 1 подвид |
| Хищные | 20 | 25 | 3 | 3 | - | 2 |
| Парнокопытные | 5 | 3 | - | 2 | - | - |
| Непарнокопытные | 2 | - | - | 2 | - | - |
| Всего | 91 | 72 | 9 | 10 | 9 | 3 вида и1 подвид |
Фауна и население рукокрылых Республики Татарстан (РТ)
Аськеев И.В., Аськеев О.В., Шулаев Н.В.
Институт экологии природных систем АН РТ
420087, Татарстан, Казань, Даурская 28; askeyev@iens.kcn.ru
Фауна и население рукокрылых изучалась в течение 1999-2002 гг. Работы проведены в 14-ти административных районах РТ с использованием маршрутных, визуальных учетов (май-август). Рукокрылых учитывали со времени захода солнца до начала рассвета, путем повторного прохождения маршрута в течение каждого часа. Ширина учетной полосы зависела от биотопической и видовой специфики. Общая протяженность маршрутов составила 73 км (всего пройдено около 450 км). В настоящее время фауна рукокрылых РТ насчитывает 12 видов (возможна встреча еще 2-х видов), все они отмечены на маршрутах. Численность рукокрылых варьировала от 4 до 18 особей/км. Средняя численность составила 7,1 особей/км. Наиболее обычными являются: лесной нетопырь (2,6 особей/км), двухцветный кожан (1,4 особей/км.), рыжая вечерница (1,4 особей/км.). Численность других видов составила: бурый ушан – 0,6 особей/км., ночница Брандта и усатая ночница (визуально не различимые) – 0,4 особей/км., водяная ночница – 0,4 особей/км., прудовая ночница и северный кожанок – по 0,2 особей/км. Ночница Наттерера, нетопырь-карлик и гигантская вечерница – единичные встречи. В лесных местообитаниях (кроме пойменных лесов) отмечено 8 видов летучих мышей (средняя численность – 9,5 особей/км.,). Преобладали – лесной нетопырь, рыжая вечерница, бурый ушан. В поймах средних и малых рек – 6 видов (средняя численность – 3,6 особей/км.). Доминирует – водяная ночница. В мелких населенных пунктах и дачных поселках – 5 видов (средняя численность – 2,3 особей/км.). Основу населения составлял двухцветный кожан. На городских территориях – 4 вида (средняя численность – 0,3 особей/км.). Наибольшего видового разнообразия и численности рукокрылые достигают в Предволжском (особенно в Свияжско-Волжском междуречье) и Западно Предкамском фаунистических районах (11 и 12 видов соответственно), где имеется масса убежищ в виде пещер, рудников, штолен, навесов и оврагов, а также сохранились значительные массивы спелых лесов.
Антропогенное влияние на структуру популяций безоарового козла на территории Дагестана
Ахмедов Э. Г., Насруллаев Н. И.
Прикаспийский институт биологических ресурсов Дагестанского научного центра РАН. 367025, Дагестан, г. Махачкала, ул. Гаджиева 45, каб.235
Безоаровый козел (Capra aegagrus Еrx. 1777) – один из редчайших видов копытных нашей страны. Современный ареал безоарового козла на территории России охватывает внутригорные районы Дагестана и приграничные с Дагестаном районы Чечни и Грузии. Исследования проводились на территории Тляратинского района Дагестана. Здесь безоаровые козлы обитают на западных склонах хребта Нукатль и на восточных склонах хребта Богосс. Изолированы эти популяции друг от друга рекой Аварское Койсу. Склоны Нукатля более труднодоступны, поэтому антропогенное воздействие на популяцию безоарового козла на Нукатле проявляется слабее, чем на Богоссе. Анализ демографической структуры популяций показал, что в обеих популяциях наиболее многочисленной половозрастной группой являются взрослые самки старше 2-х лет. Они составляют на Нукатле 34,2% от всех животных, на Богоссе – 33,8%. Количество сеголеток 25,0 и 27,1%, взрослых самцов 22,4 и 22,7%, годовалых особей 16,4 и 18,4% соответственно. Различия между этими популяциями проявляются в возрастном распределении самцов. Самцы старше 7 лет в популяции, населяющей хребет Нукатль, составляют 21% от общего количества самцов, в популяции населяющей Богосс - всего 10,5%. Основным фактором, определяющим демографическую структуру популяций безоарового козла в условиях Восточного Кавказа, является браконьерский отстрел животных, степень влияния которого на отдельные половозрастные группы зависит от характера их пространственного распределения и доступности для охотников, т.е. ее орографических особенностей.
Работа выполнена при финансовой поддержке РФФИ (проекты № 01-04-49647 и № 01-04-63143)