Материалы Международного совещания [241..250]
Домовая мышь в природных биотопах и посёлках Западного Казахстана
Окулова Н.М.*, Гражданов А.К.**, Маштаков В.И.**, Медзыховский Г.А.**
* Институт проблем экологии и эволюции им. А.Н. Северцова РАН, Москва,
119071, Ленинский пр-т, 33. natmichok@mtu-net.ru
** Уральская противочумная станция, 417001, Казахстан, г. Уральск, ул. Чапаева, д. 36/1
В сообщении использованы наблюдения зоологов Уральской противочумной станции за 1949-1998 гг. Домовую мышь Mus musculus (ДМ) учитывали давилками Геро. В природе ДМ имеет более устойчивую, чем у других мелких млекопитающих, хотя и невысокую численность Многолетняя средняя численость составляет в разных частях области весной 1.2, осенью – 4.04 зв/100лс. Максимальная численность отмечена в ландшафте глинистых полупустынь Центральной приуральной части (окр. п. Фурманово) – 9.6 зв/100лс, минимальная – на юге области, в песках окр. пп. Калмыково, Урда (0.93-1.34). ДМ доминирует в населении мелких млекопитающих природных биотопов. Её доля в населении зверьков особенно высока в сухие годы (до 98%) и снижается во влажные годы за счёт роста численности полёвок. Статистический тип распределения данных многолетних учётов в природе, как правило, отклоняется от нормального и ближе к логнормальному распределению. Анализ этих данных показал, что в оптимальном для вида участке области (окр. п. Фурманово) для зверьков благоприятны: сниженная геомагнитная активность, низкий среднегодовой уровень Каспийского моря, увеличенное количество осадков в июне и сентябре предыдущего года, высокая предшествующая численность. Во всех участках отмечено возрастание (тренд) численности от года к году. В песчаном северо-восточном районе ряд многолетних показателей осенней численности ДМ в природе имеет нормальное распределение, что позволило более подробно изучить факторы динамики численности ДМ параметрическими методами. В посёлках ДМ составляет до 99% в населении зверьков при численности около 10 на севере и в центре, до 5.5 зв/100лс на юге области. Кратность многолетних колебаний численности не более чем 3-х кратная (в природе более чем 8-20 кратные). Распределение данных многолетних учётов нормальное, тренда численности не отмечено. В отличие от бытующих представлений выявлена зависимость колебаний численности ДМ в посёлках от ряда внешних факторов, таких как уровень Каспия, температуры июня и сентября, осадки марта и августа предыдущего года, а также осадки марта в год учёта. Составлены уравнения для прогноза колебаний численности ДМ.
Динамика корреляционных связей в щитовидной железе крапчатого суслика в постнатальный период.
Олейник Ю.Н.
Одесский национальный университет им.И.И.Мечникова
65062,Украина, г.Одесса, Фонтанская дорога, 63 bvr@ua.fm
Приспособление организма суслика в постнатальный период к его новому положению в окружающей среде предполагает, исходя из принципа системности, способность и к индивидуальному приспособлению отдельных органов к изменению условий обитания. В ранний постнатальный период, характеризующийся переходом от внутриутробного развития к наземно-воздушному существованию, происходит формирование структурной организации щитовидной железы. В период от реализации антигравитационных реакций до залегания в спячку, когда осуществляется значительная перестройка пищевых связей, увеличивается двигательная активность и происходит расселение молодых сусликов завершаются ростовые процессы, связанные с увеличением размеров фолликулов, числа тироцитов в фолликуле. В процессе постнатального развития происходит изменение не только признаков щитовидной железы, но и уровня скоррелированности между ними. Последний будучи наибольшим на первом этапе развития щитовидной железы (до момента прозревания), заметно уменьшается к моменту первых выходов суслят из гнезда. Такая раскоррелированность, а также снижение скорости роста железы предшествует физиологической перестройке, обеспечивающей новый уровень взаимодействия с окружающей средой. Уменьшение коррелятивных связей позволяет осуществить перестройку в кратчайшее время и требует от животного минимальных энергозатрат. С переходом к самостоятельному существованию число коррелятивных связей вновь увеличивается, но уже не достигая при этом уровня, характерного для раннего постнатального периода. Число корреляционных связей к концу второго этапа постнатального развития уже существенно не отличается от аналогичного показателя щитовидной железы сусликов старших возрастных групп. Учитывая, имеющиеся данные о существенно более высоком уровне скоррелированности признаков растущего органа, чем сформированного, следует рассматривать результаты корреляционного анализа как подтверждение вывода о завершении формирования щитовидной железы крапчатого суслика к 2 месяцам постнатального развития.
Использование пространства и соотношение полов у половозрелых землероек-бурозубок
Олейниченко В.Ю.
Биологический ф-т МГУ им. М.В. Ломоносова
119899, Москва, Воробьевы Горы, МГУ, д.1, корп. 12 oleinich@orc.ru
С применением индивидуального мечения на линиях живоловок изучалось использование пространства перезимовавшими Sorex araneus, S. caecutiens и S. minutus на Ю.-З. Тверской обл. Как известно, половозрелые самки бурозубок территориальны. Участки самок разных видов изолированы друг от друга. Участки половозрелых самцов превышают размеры участков самок в десятки раз, включая, в том числе, и свои прошлогодние участки. Наблюдавшаяся площадь была подразделена на зоны: “A” – самки отсутствуют, “B” – участки самок, “C” – их ближайшие окрестности, a priori примерно равные по площади самим участкам. Для этих зон оценены: размеры; число самцов на единицу площади (плотность самцов); среднее число поимок на каждого из них (продолжительность пребывания и/или активность самцов); для зон “В” и “С” - число самцов на 1 самку (“обеспеченность самок самцами”). Зона “А” менее других используется самцами и служит им лишь для передвижения от самки к самке. Зона “С” служит местом концентрации самцов вокруг зоны “В” и близка к ней по ряду параметров. Различия между этими зонами могут быть связаны с особенностями поведения самок в период диэструса по отношению к самцам. Межвидовые различия: S. araneus имеет наименьшие размеры “В” и “С” зон, но самую высокую “обеспеченность самок самцами” в каждой из них. По плотности самцов они практически одинаковы между собой. S. caecutiens имеет самые большие размеры зон “В” и “С” и наибольшую продолжительность пребывания (и/или активность) самцов в них, а также наибольшее превышение плотности самцов в зоне “B” над таковой в зоне “С”. S. minutus занимает промежуточное положение по размеру зон и имеет наименьшие значения остальных параметров по сравнению с другими видами. Исследование проведено в сотрудничестве с ИПЭЭ РАН.
Сезонная динамика доминирования в сообществе мелких млекопитающихсухих предгорий Дагестана
Омаров К.З., Магомедов М.-Р.Ш.
Прикаспийский институт биологических ресурсов ДНЦ РАН
Республика Дагестан, г.Махачкала, ул.М.Гаджиева, 45, mmrd@iwt.ru
Интерес к особенностям функционирования многовидовых сообществ напрямую связан с концепцией экологической ниши, конкурентного исключения и структурной организации сообществ. Удобной моделью для такого рода исследований являются сообщества мелких млекопитающих, характеризующиеся ярко выраженной цикликой, природа и механизмы которой до сих пор полностью не распознаны. В период с сентября 2001 г. по сентябрь 2002 г. нами изучалась сезонная динамика населения микромаммалия в предгорной зоне Дагестана. Отработанно 1018 давилко/ночей (давилки Геро), отловлено 104 особей мелких млекопитающих, относящихся к четырем видам (таблица снята редколлегией).
В осенне-зимний период в уловах абсолютно доминирует желтогорлая мышь. Весной и летом картина доминирования резко меняется и в уловах попадались все 4 вида, с наибольшей долей приходящейся на лесную соню (38-46%). После зимнего сокращения плотности лесной мыши возрастает роль и общественной полевки, удельная уловистость которой от весны к лету возрастает от 19 до 34%. Удельная доля желтогорлой мыши в весенних и летних отловах оставалась без изменений - 19-20%. Помимо грызунов в весенних отловах отмечена и бурозубка Волнухина (24%). Т. о., прослеживается четкая связь асинхронности в динамике численности различных видов с особенностями сезонной смены обилия различных типов кормов в природе и пищевой специализации рассматриваемых видов, что способствует максимальному использованию ресурсов среды.
Особенности организации основной обонятельной луковицы амфибий и млекопитающих в сравнительном аспекте.
Омельковец Я.А., Степанюк Я.В.
Волынский гос. университет им. Леси Украинки
43025 Волынская область, г. Луцк, проспект Воли, 13. Slava1978@ukr.net
Основная обонятельная луковица с точки зрения своей стуктурной организации представляет собой значительный интерес для нейрогистологов. Она достаточно детально описана у млекопитающих, и хуже у земноводных, у которых существенно изменилась с выходом на сушу. Исследования проводились на серийных срезах bulbus olfactorius амфибий (Rana temporaria, Rana esculenta, Bufo bufo) и млекопитающих (Nyctalus noctula, Talpa europeae, Erinaceus europeus, Crocidura leucodon, Mus musculus, Tupaia glis), окрашенных по Нислю. В луковице млекопитающих выделили 6-7 слоев клеток у земноводных – 5. Внешний волокнистый слой отличительных особенностей не имеет. Гломерулярный слой состоит из клубочков, объём которых больше у млекопитающих. Внешний плексиморфный слой хорошо выражен у млекопитающих и состоит из пучковых клеток, которые похожи на митральные, но меньше по размерам. В амфибий между внешним слоем, а также митральным и внутренним плексиморфным нету чётких границ, поэтому правильнее говорить о едином плексиморфном слое. Митральные клетки млекопитающих сконцентрированы в 1-2 концентрических ряда, а у земноводных разпределены диффузно. Зернистый слой, а также внутренний слой волокон и глии состоят из клеток-зёрен (гранулярные клетки) и клеток эпендимы. Клетки-зёрна млекопитающих, в отличии от амфибий залегают в виде гроздей или островков, которые разделены волокнами. Анализируя цитоархитектонику основной обонятельной луковицы земноводных и млекопитающих, можно сделать вывод о более прогрессивной организации этого органа у млекопитающих.
Аномалии в строении челюстного аппарата бурозубок (Insectivora, Sorex)
Онищенко С.С., Ильяшенко В.Б., Бибик Е.В.
650043 Кемерово, ул. Красная 6, Кемеровский госуниверситет bios@kemsu.ru
Известные редкие аномалии в строении зубной системы бурозубок сводятся к изменению числа промежуточных зубов. Анализ коллекций сибирских бурозубок КемГУ и ИСиЭЖ СО РАН (просмотрено около 3500 экз.) позволил выявить и другие варианты врожденных отклонений в морфологии структур черепа:
а) слияние оснований коронок соседних промежуточных зубов. Обнаружено у единичных экземпляров S.roboratus из Кемеровской обл. и у S. caecutiens из Томской обл.;
б) аномальное изменение формы коронки одного из промежуточных зубов. У экземпляра S. isodon из Сохондинского заповедника коронка 2-го зуба имела вид тонкого вытянутого треугольника;
в) недоразвитость отдельных промежуточных зубов. Этот вариант встречается несколько чаще. В серии S.roboratus из Юго-Восточного Алтая у 1 экземпляра был недоразвит 5-й зуб, а у другого - 2-й, который по своей величине был меньше 5-го. У S. tundrensis из этого же сбора недоразвит 4-й зуб и по своей величине сопоставим с 5-м. В ряду зубов нижней челюсти экземпляра S. caecutiens из Новосибирской обл. имелись слаборазвитые непигментированные Pm1;
г) Более распространено отклонение, классифицированное нами как нарушение прикуса. Выявляется только у сеголеток по наличию ненормально стертых участков нижних резцов и одной или обеих вершин верхних резцов. Иногда подтертыми могут быть вершины передних промежуточных зубов, а также Pm1. Видимо, нарушение прикуса приводит к усилению нагрузки на отдельные участки зубного ряда и вызывает интенсивное их изнашивание вплоть до полного разрушения передней части I1. Это обнаружено в западносибирских сборах S. araneus, S. isodon, S. roboratus, S. daphaenodon с частотой встречаемости 1 случай на 100 или более животных. Однако в серии S. araneus (60 экз.) из Томской обл. таких животных оказалось 8 экз. (12 %), что сопоставимо с частотой проявления олигодонтии у S.roboratus из Юго-Восточного Алтая, описанной нами ранее (2001). Случаи локального увеличение частоты врожденных аномалий у бурозубок требует детального изучения.
Травмы и деформации черепа бурозубок (Insectivora, Sorex)
Онищенко С.С., Ильяшенко В.Б., Бибик Е.В.
650043 Кемерово, ул. Красная 6, Кемеровский госуниверситет bios@kemsu.ru
Для расширения представлений о травматической изменчивости анализировались бурозубки сибирских видов, имевших прижизненные травмы и деформации черепа. Часто встречаются травмы рострума. Они сопровождаются частичным разрушением резцов (одного или обоих) и нескольких промежуточных зубов (с одной или обеих сторон); зарастанием альвеол; частичной или полной депигментацией вершин отдельных зубов в верхней и/или нижней челюстях; сточенностью или сколом эмали вершин зубов; изгибанием ростральной части черепа влево, вправо или вниз. Отдельные зубы или части их коронок с поврежденного участка рострума могут смещаться на его боковую поверхность, где затем врастают в тело кости. Имеются случаи повреждения нижних челюстей. Поверхностные травмы приводят к появлению наростов на кости, причем в исключительных случаях обрастают и примыкающие части коронок зубов. Перелом нисходящей ветви может сопровождаться утратой отдельных зубов, а ее срастание - частичной и полной депигментацией зубов на поврежденном участке челюсти, изменением формы нисходящей ветви челюсти. Проникающие ранения участков лицевого и мозгового отделов черепа имеют вид углублений в кости или «окон» с костными наростами по краям. У отдельных экземпляров искривлен лицевой отдел без видимых следов травм. Это нарушение проявлялось в одностороннем искривлении носовой части черепа и нижних челюстей, в различной сточенности верхних и/или нижних резцов, а также промежуточных зубов, в сжатии на одной из сторон верхней челюсти зубного ряда за счет более плотного расположения зубов, в компенсаторном разрастании на одной из челюстей вершины венечного отростка. Травмированные зверьки встречаются редко, в основном - сеголетки. Предполагается, что большая часть травм получена ими на ранних этапах постнатального развития. Это период интенсивного роста и формирования скелета животных, что может также способствовать заживлению ран, и в ряде случаев ведет к сопряженным изменениям в черепе (искривления рострума, депигментация зубов и др.).
Реакклиматизация русской выхухоли в заповеднике «Брянский лес»
Онуфреня А.С., Онуфреня М.В.
Окский биосферный гос. природный заповедник
391072 п/о Лакаш, Рязанская область, Спасский район, п. Брыкин Бор
На протяжении последних десятилетий положение с русской выхухолью остается крайне тревожным – происходит неуклонное сокращение ее численности и раздробление ареала. Основная причина - интенсивная деятельность человека, вызывающая уничтожение мест обитания эндемика, а также истребление поголовья. Один из реальных путей расширения современного ареала вида - восстановление уничтоженных популяций в сохранившихся угодьях на особо охраняемых территориях, где браконьерство сведено до минимума. Обследования, проведенные сотрудниками Окского заповедника, показали, что одним из перспективных мест восстановления прежнего очага обитания является территория заповедника “Брянский лес”. В состав данной ООПТ, созданной в 1987 г., входят пойменные угодья р. Нерусса, где выхухоль встречалась еще 2-3 десятилетия назад. Причиной исчезновения вида явилась браконьерская охота и лов рыбы ставными снастями. Современное состояние водных угодий и их емкость, а также налаженный режим контроля, устраняющий основной лимитирующий фактор, являются надежными гарантами для существования в границах заповедника жизнеспособной популяции эндемика. В перспективе возможно расселение его из мест интродукции по бассейну р. Десна, где выхухоль в свое время была обычна. Выпуск 10 пар зверьков на территории заповедника “Брянский лес” проведен в сентябре 2002 г. в заранее выбранные пойменные водоемы. Места выпуска находятся под постоянным контролем сотрудников заповедника. Выхухоль завезена из Окского заповедника, где плотность населения популяции позволяет изъимать без ущерба часть поголовья на расселение.Для оценки сохранности и успешности размножения эндемика в 2003 г. необходимо провести подробное обследование угодий заповедника «Брянский лес» с привлечением квалифицированных специалистов. В том случае, если результаты акклиматизации будут положительны, целесообразно осуществить выпуск еще одной партии выхухоли для ускорения процесса формирования гарантированно жизнеспособной популяции на данной территории.
Работа выполнена при финансовой поддержке Фонда национальных парков.
Выхухоль в Ростовской области
Онуфреня А.С., Онуфреня М.В., Лебединец Ю.В
Окский биосферный гос. природный заповедник
391072 п/о Лакаш, Рязанская область, Спасский район, п. Брыкин Бор
Комитет по охране окружающей среды и природных ресурсов Ростовской обл.
344010 г.Ростов-на-Дону, пр. Ворошиловский, 46/176
Сведения о численности и распространении русской выхухоли в Ростовской области весьма скудны и противоречивы. Последние 50 лет поголовье ее оценивается как “единичные встречи”. Осенью 2002 г. сотрудники Окского заповедника совместно с представителями КПР Ростовской области провели рекогносцировочное обследование пойменных угодий региона. Цель мероприятия – подтверждение факта присутствия выхухоли на территории области и оценка ее численности на отдельных участках. По результатам обследования особо следует выделить пойменные угодья р. Дон в границах Шолоховского и Верхнедонского р-нов. Здесь, на площади порядка 150 тыс. га, расположено большое количество пойменных озер, соединенных протоками в единую систему. Выборочно осмотрено более 30 % угодий, численность выхухоли оценена как высокая. Относительный показатель ее – 11 нор на 1 км береговой линии. Очевидно, что данный показатель не может быть общим для всей этой территории, поскольку осматривались наиболее перспективные, с точки зрения пригодности для обитания выхухоли, участки. Принимая во внимание эту поправку, авторы настоящего сообщения, тем не менее, расценивают данную группировку как одну из крупнейших в масштабах современного ареала. Говорить об общей численности и размерах местной популяции не представляется возможным без более детального обследования данного пойменного участка, а также прилегающих районов Воронежской и Волгоградской областей. Высокий бонитет осмотренных угодий в полной мере отвечает необходимым требованиям для успешного существования эндемика. К отрицательным моментам следует отнести многочисленные следы сетевого лова рыбы. На оз. Долгое найдена выхухоль, погибшая в ставной сети. Учитывая общуюю ситуацию с выхухолью в стране необходимо принять экстренные меры по сохранению данной группировки эндемика. Один из таких путей – создание на территории Шолоховского и Верхнедонского р-нов особо охраняемой природной территории, как минимум, регионального значения.
Фаунистический комплекс мелких млекопитающих типичных и сухих степей Заволжья и его вековая динамика под действием природных и антропогенных факторов
Опарин М.Л.1, Опарина О.С.1, Тихонов И.А.2, Ковальская Ю.М2.
1 Саратовский филиал Института проблем экологии и эволюции им. А.Н. Северцова РАН.
Россия, 410028, Саратов, Рабочая, 24 otis@forpost.ru
2 Институт проблем экологии и эволюции им. А.Н. Северцова РАН.
Россия, 117071, Москва, Ленинский проспект, 33 tikh@biostation.chg.ru
Распашка степей саратовского Заволжья началась во второй половине ХIX века, и пашня к началу XX века занимала 35,7% от площади района, а пастбищная нагрузка составляла 1,4 головы условных овец на гектар пастбищ. Второй этап сельскохозяйственной трансформации степных экосистем Заволжья пришелся на средину 50-х – начало 60-х годов XX века. Распаханность Сыртовой равнины Заволжья была доведена до 58,5%, а на оставшихся 29,2% естественных пастбищных угодий пастбищная нагрузка составила 7,4 головы условных овец на гектар. Это привело к пастбищной дигрессии степной растительности и ее ксерофитизации. Конец XX века ознаменовался резким снижением сельскохозяйственной нагрузки. Около 31% пашни перешло в залежи, а пастбищная нагрузка на естественные пастбища сократилась до 0,5-0,7 головы условных овец на гектар. На залежах и пастбищах начались процессы демутации растительности, обусловившие мезофитизацию местообитаний мелких млекопитающих в описываемом регионе. Они совпали по времени с гумидной фазой многовекового и внутривекового климатических циклов, годовая норма осадков в этот период превысила многолетнюю среднюю на 60-80 мм. Анализ литературных данных показал преобладание ксерофильных элементов в фауне мелких млекопитающих саратовского Заволжья в первую половину ХХ столетия. Наши исследования, выполненные в последнее десятилетие, показали увеличение обилия и расширение ареалов к югу у 8 видов, из них 77% имеют оптимум ареала в лесной зоне, сократили обилие и сузили свои ареалы к югу 6 видов, из них 67% имеют оптимум ареала в степной зоне, а 33% - в пустынной. Следовательно, увеличили обилие и расселились в подзоне сухой степи Волго-Уральского междуречья виды мезофильного, а уменьшили обилие и сократили ареалы виды ксерофильного комплексов. Из 9 видов, не изменивших обилия, три относятся к представителям мезофильного комплекса, а шесть – ксерофильного. Как правило, виды ксерофильного комплекса, не изменившие своего обилия, приспособились к обитанию на посевах и залежах.
Канализированность эволюции кариотипа обыкновенной бурозубки Sorex araneus L.
Орлов В.Н., Козловский А.И., Черепанова Е.В.
Институт проблем экологии и эволюции им. А.Н.Северцова Российской академии наук,
Москва, 119071, vikorlov@freemail.ru
В Восточной Европе хромосомные расы обыкновенной бурозубки отличаются различными робертсоновскими соединениями 10 пар акроцентрических хромосом, обозначаемых латинскими буквами “g,h,i,k,m,n,o,p,q,r” в алфавитном порядке по убыванию размеров хромосом. Образующиеся метацентрические хромосомы (максимально 5 пар) мы называем диагностическими (ДХ). При этом теоретически возможно образование 45-ти различных ДХ, из которых в настоящее время обнаружено 36.
Как только метацентрик достигнет в популяции высокой частоты, распространение других метацентриков, неполной с ним гомологии, становится невозможным. Так, метацентрик gm не сможет проникнуть в популяцию с метацентриком go, а hi - в популяцию с hn. Высокая частота любой ДХ препятствует распространению в ее ареале 16 других хромосом неполной с ней гомологии, фиксация двух из пяти ДХ препятствует распространению в их ареале 28 хромосом, а фиксация трех хромосом – 39 (из 45). Сопоставление кариотипов западноевропейских хромосомных рас обыкновенной бурозубки показывает, что первой хромосомной перестройкой, вероятнее всего, была hi. Поэтому большая часть нереализованных соединений хромосом, 7 из 9, приходится на хромосомы неполной гомологии с hi. Восемь обнаруженных хромосом неполной гомологии с hi распространены в Восточной Европе и Сибири и лишь метацентрик gi встречается, также, в Западных Альпах в рано дивергировавшей расе “Valais”.
Фиксация любой пары ДХ в значительной мере определяет (канализирует) дальнейшую эволюцию кариотипа. Фиксация двух, а тем более трех метацентриков резко сужает возможности дальнейшей эволюции кариотипа путем центрических соединений. Чаще это свидетельствует о длительной совместной эволюции подобных популяций, но, в тоже время, создает предпосылки возможной параллельной эволюции географически удаленных групп хромосомных рас.
Одна из рас, предсказанная в гипотетической схеме родственных связей финских и уральских рас на основе разных хромосомных перестроек (Halkka et al., 1994), действительно была в дальнейшем обнаружена на Урале (раса «Серов») (Polyakov et al., 1997). Это обстоятельство, тем не менее, не доказывает правильность предложенной гипотетической схемы эволюции финских рас, а объясняется отмеченной выше канализированностью процессов эволюции кариотипа.
Группу хромосомных рас, имеющих три общих ДХ, мы назвали "кариотипической семьей" (Орлов, Козловский, 2002). В каждой «семье» теоретически возможно возникновение только 10 хромосомно отличающихся рас, в том числе трех - с полностью метацентрическими хромосомами. Поэтому не составляет труда предсказать возможность существования в любой хромосомной семье еще не обнаруженных хромосомных рас. Такие расы действительно могут быть найдены независимо от того, как мы представляем гипотетический путь их эволюции.
Работа проведена при финансовой поддержке Российского Фонда Фундаментальных Исследований (грант 00-04-49142).
Реципрокные транслокации в эволюции кариотипа обыкновенной бурозубки Sorex araneus L. – цитологическая иллюзия
Орлов В.Н., Козловский А.И., Черепанова Е.В.
Институт проблем экологии и эволюции им. А.Н.Северцова Российской академии наук,
Москва, 119071, vikorlov@freemail.ru
 Различия кариотипов близких видов и хромосомных форм грызунов, хищных и копытных млекопитающих нередко выглядят как реципрокные транслокации. Гипотетические крупные хромосомные перестройки - реципрокные транслокации целых плеч метацентрических хромосом (WART) - иногда используют в реконструкциях эволюционных изменений кариотипа. Так, неоднократно предлагались схемы эволюции кариотипа домовой мыши и обыкновенной бурозубки, основанные на WART. Следует подчеркнуть, что полиморфизм по таким транслокациям до сих пор не обнаружен в природных популяциях млекопитающих. Кроме того, предложенные схемы эволюции кариотипов полностью игнорируют хорошо известную способность хромосомных мутаций распространяться по ареалу вида.
Различия кариотипов близких видов и хромосомных форм грызунов, хищных и копытных млекопитающих нередко выглядят как реципрокные транслокации. Гипотетические крупные хромосомные перестройки - реципрокные транслокации целых плеч метацентрических хромосом (WART) - иногда используют в реконструкциях эволюционных изменений кариотипа. Так, неоднократно предлагались схемы эволюции кариотипа домовой мыши и обыкновенной бурозубки, основанные на WART. Следует подчеркнуть, что полиморфизм по таким транслокациям до сих пор не обнаружен в природных популяциях млекопитающих. Кроме того, предложенные схемы эволюции кариотипов полностью игнорируют хорошо известную способность хромосомных мутаций распространяться по ареалу вида.
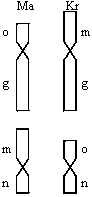
По нашему мнению, видимость участия WART в эволюции обыкновенной бурозубки возникает, во-первых, вследствие канализированности процессов эволюции кариотипа и, во-вторых, вследствие ограничений в распространении по ареалу вида метацентриков с неполной гомологией (Орлов и др. в этом сборнике). Гибридные зоны многих хромосомных рас образованы именно такими метацентриками. Ошибочность предположения о роли WART очевидна в тех группах хромосомных рас, где формирование метацентрических кариотипов еще не завершилось (многие западноевропейские и прибалтийские расы). Хромосомные различия, которые при сравнении рас можно принять за WART, возникают в результате миграции метацентриков из соседних популяций. Метацентрические кариотипы рас Северо-Востока Европы и внеледниковой области Восточной Европы сформировались без участия WART в результате интрогрессии хромосом рас «Москва» и «Кириллов». Различия рас «Мантурово» (Ma) и «Кириллов»(Kr) можно принять за WART (рис.). Однако, очевидно, что эти расы принадлежат к разным эволюционным линиям и встретились в результате миграции западноевропейских популяций обыкновенной бурозубки (Козловский и др., настоящий сборник). Далее, косвенным подтверждением гипотезы интрогрессии метацентрика pq из расы «Москва» в соседние расы может служить следующий факт. Три польских расы, географически близкие, но резко отличающиеся по кариотипам («Дрнголец», «Лэгуцки Млын» и «Гусовы Млын») не имеют пятой диагностической хромосомы pq именно потому, что в Прибалтику не проникли популяции расы «Москва» или «Нерусса» с этим метацентриком.
Работа проведена при финансовой поддержке Российского Фонда Фундаментальных Исследований (грант 00-04-49142).
Новые данные о распространении расы «Москва» и выделение новой хромосомной расы («Пенза») обыкновенной бурозубки Sorex araneus L.
Орлов В.Н., Козловский А.И., Булатова Н.Ш., Балакирев А.Е., Малыгин В.М.
Институт проблем экологии и эволюции им. А.Н.Северцова Российской академии наук,
Москва, 119071, vikorlov@freemail.ru
Московский государственный университет
Известный ареал расы «Москва» охватывает значительную часть бассейна Верхней Волги от оз. Селигер на севере до Оки на юге, бассейна р. Ловать (обнаружена в верховьях р. Сережа) на западе, и верховий Днепра на юго-западе (обнаружена в окр. Издешково Смоленской области) (Bulatova et al., 2000; Kozlovsky et al., 2000). Оставались неясными восточные границы распространения этой расы. Полученные нами новые данные указывают на то, что на востоке ареал расы «Москва» приближается к Волге севернее впадения Оки (обнаружена в окр. Палеха и Южи, по левобережью р. Клязьмы).
Таким образом, ареал расы «Москва» расчленяет ранее описанную расу «Молога» на два участка - северный и южный. В начале голоцена степи продвинулись на запад в междуречье Верхней Волги и Клязьмы (современные Владимирское и Суздальское ополья). Возможно, что именно это наступление степей разделило ареал расы «Молога», а в последовавший влажный атлантический период (8-5 тыс. л. н.) Ополья заселила раса «Москва».
В соответствии с правилами описания хромосомных рас обыкновенной бурозубки мы считаем возможным выделить северный и южный изолированные участки в самостоятельные расы. Название «Молога» (Orlov et al., 1996) следует сохранить за северным участком, а южный описать в качестве самостоятельной расы «Пенза».
Раса «Пенза» (Pn)
XX/XY1Y2 af, bc, gm, hn, i/o, j/l, kr, p/q, tu
Место типа расы: Земетчинский р-н Пензенской обл., правый берег р. Ленгас (Bulatova et al., 1999). Распространение см. Bulatova et al. (2000). В качестве отличия от расы «Молога» можно указать на фиксацию метацентрика gm.
Работа проведена при финансовой поддержке Российского Фонда Фундаментальных Исследований (грант 00-04-49142).
ПОЗДНЕПЛЕЙСТОЦЕНОВЫЕ SORICIDAE СЕВЕРНОГО КАВКАЗА
Осипова В.А., Зайцев М.В.
Зоологический институт РАН
199034, Санкт-Петербург, Университетская наб., 1; microtus@zin.ru
Современная фауна насекомоядных млекопитающих Кавказа характеризуется высоким уровнем разнообразия и эндемизма. Ископаемая фауна землероек Кавказа изучена крайне слабо, что связано с практически полным отсутствием остатков Soricidae в данном регионе. До последнего времени существовали лишь единичные упоминания о плейстоценовых находках (Верещагин, 1959). Более полные данные об ископаемых Soricidae Кавказа были получены в результате исследования среднеплейстоценового материала из пещеры Треугольная (Карачево-Черкесия) (Zaitsev, Baryshnikov, 2002).
Позднеплейстоценовый материал получен в результате раскопок четырех пещер Северного Кавказа: Матузка, Мезмайская, Монашеская и Мушты-Лагат. Исследовано 375 остатков. Выяснено, что по видовому составу позднеплейстоценовая фауна Soricidae Северного Кавказа практически не отличается от современной. Она включает Neomys sp., Sorex volnuchini, S. cf. satunini и S. cf. raddei. Помимо этих видов обнаружена крошечная бурозубка, обитающая ныне в лесной зоне Евразии. Характерным является полное отсутствие белозубок рода Crocidura.
Известно, что на северном склоне Большого Кавказа в течение плейстоцена имели место неоднократные изменения климата, вызывавшие смещение границ высотных поясов. В холодные этапы отмечена аридизация высокогорных районов (Барышников, Голованова, 1989). По материалам, полученным из этих же местонахождений, отмечено соответствующее изменение в составе фауны грызунов и зайцеобразных (Барышников, Голованова, 1989). Изменение фауны Soricidae этого региона происходило иным образом. На фоне общего обеднения видового состава экологические группировки оставались сравнительно стабильными. В частности, в среднем плейстоцене на Северном Кавказа было обнаружено 6 видов рода Sorex (S. minutissimus, S. aff. minutus, S. volnuchini, S. satunini, S. raddei, S. doronichevi), 1 вид рода Drepanosorex (D. rupestris) и 2 вида рода Neomys (N. hintoni, N. newtoni). В позднеплейстоценовой фауне обнаружено только 4 вида бурозубок и 1 вид кутор. Интересно, что в периоды практически полного доминирования горно-луговых видов грызунов среди землероек продолжают преобладать типично лесные виды, что, по-видимому, связанно с высокой экологической пластичностью бурозубок.
Работа выполнена при поддержке РФФИ (гранты №№ 00-04-48452а и 01-04-63140к)
Межвидовые поведенческие взаимоотношения красных Clethrionomys rutilus и красно-серых C. rufocanus полевок
Осипова О.В.
Институт проблем экологии и эволюции им. А.Н.Северцова РАН,
Ленинский пр. 33, Москва 119071, Россия; osipova@ipee.chg.ru
Межвидовые отношения красных и красно-серых полевок изучали в десяти двухвидовых группах в вольерах площадью 120 кв. м. На первой стадии исследовали поведение полевок в одновидовых группах (по 2 самки и 4 самца в каждой). Через три недели одновидовые группы объединяли. Кроме того, в четырех группах за красными полевками наблюдали после изъятия красно-серых. Двухвидовые группы существовали 2-3 месяца; общая продолжительность наблюдений составила около 1300 часов. Во всех группах зафиксировано абсолютное поведенческое доминирование красно-серых полевок над красными. Межвидовые взаимодействия представляли собой агрессию и избегания. Инициаторами агрессии были только красно-серые полевки. Избегания были присущи в большей степени красным полевкам. В пяти группах отмечено значительное влияние присутствия красно-серых полевок на социальную структуру красных. В двух из них произошло практически полное разрушение социальной структуры красных полевок, в трех – ее естественное развитие, сопровождающее репродуктивное созревание зверьков, было задержано. В этих группах не наблюдали иерархических отношений у красных полевок. Репродуктивное поведение у красных полевок было отмечено только в трех двухвидовых группах. Однако в них ни разу не отмечено рождение детенышей. В то же время красно-серые полевки успешно размножались в присутствии красных в восьми группах из десяти. Внутривидовые отношения у красно-серых полевок практически не изменились после формирования двухвидовых групп. Изъятие красно-серых полевок привело к восстановлению социальной структуры красных полевок или к естественному развитию у них социальных процессов. В двух таких группах самки красных полевок выкормили потомство.
Работа поддержана РФФИ, гранты №№99-04-48324 и 02-04-48421
Межвидовые поведенческие взаимоотношения красно-серых Clethrionomys rufocanus и темных Microtus agrestis полевок
Осипова О.В.
Институт проблем экологии и эволюции им. А.Н.Северцова РАН,
Ленинский пр. 33, Москва 119071, Россия; osipova@ipee.chg.ru
Межвидовые отношения красно-серых и темных полевок изучали в восьми двухвидовых группах в вольерах площадью 120 кв. м. На первой стадии исследовали поведение полевок в одновидовых группах (по 3 самки и 3 самца в каждой). Через три недели одновидовые группы объединяли. Двухвидовые группы существовали 2-3 месяца; общая продолжительность наблюдений составила более 1000 часов. Характер межвидовых отношений полевок значительно варьировал. В пяти группах в течение первой недели, а в одной в течение месяца, отмечен паритет в агрессивных взаимодействиях: зверьки обоих видов атаковали друг друга. Лишь в двух группах с самого начала было зафиксировано четкое доминирование темных полевок над красно-серыми. Еще в пяти случаях в итоге доминантами стали темные полевки, а в одном – красно-серые. В единственной группе с доминированием красно-серых полевок одна из самок этого вида дала четыре выводка, но выжил лишь один детеныш. В трех группах детеныши появлялись одновременно у самок обоих видов. В одной из групп они все погибли, а в двух других только самки темных полевок успешно выкормили свои выводки. Еще в трех группах выводки появились только у темных полевок, но в двух из них они вскоре также погибли. Присутствие особей другого вида, по-видимому, является стрессовым фактором для зверьков обоих видов. Межвидовые взаимодействия полевок сводились в основном к агрессии и избеганиям. Формирование двухвидовых групп приводило к изменениям в структуре внутривидовых взаимодействий у обоих видов, но в большей степени - у подчиненного вида. Изъятие в одной из групп темных полевок привело к некоторому восстановлению типичного соотношения различных контактов у красно-серых полевок.
Работа поддержана РФФИ, гранты №№99-04-48324 и 02-04-48421
К экологии волка Canis lupus Якутии
Охлопков И.М., Седалищев В.Т., Однокурцев В.А.
Институт биологических проблем криолитозоны СО РАН
677891, Республика Саха(Якутия), Россия, г. Якутск, проспект Ленина 41 imokhlopkov@yandex.ru
Достоверные сведения о численности волка в Якутии отсутствуют. По отрывочным подсчетам О.В. Егорова (1965), общее поголовье волков в Якутии в 1963-64 гг. составляло 500-700 голов. По Ю.В. Лабутину и В.П. Вшивцеву (1985) в 1978-79 гг. обитало около 2000 волков. За период ч 1991 по 2001 гг. в Якутии было добыто 8731 волка. При экстраполяции учетных данных (с учетом того, что с 1996 г. по 2001 г. ежегодно в среднем добывалось 789 хищников) можно предположить, что в 2001-02 гг. в Якутии численность вида достигает около 3000 голов. С 1992 по 2001 гг. волки задрали в Якутии 133,7 тыс. домашних оленей и 13,2 тыс. лошадей. С 1997 по 1999 гг. нами обследовано 68 волков (36 самцов и 32 самки), которые были добыты (с вертолета) в конце марта-начале апреля в различных регионах Якутии. У 11 беременных самок среднее количество эмбрионов составляло 5,6 (Limit 5-7). Среди эмбрионов в половом соотношении преобладали самцы (57,1%). В конце марта все одного эмбриона был равен 327 г, в начале апреля (3 самки) он весил 456 г, а в конце апреля (4 самки) – 510 г. У 31 волка проведено гельминтологическое исследование и зараженность составила 87,1%. Обнаружено 5 видов гельминтов: 3 вида цестод – Multiceps serialis, Echinococcus granulosus, Taenia sp., 1 нематод – Toxaris Leonia и 1 трематод – Alaria alata. Установлено, что наиболее сильно волк поражен цестодой Echinococcus granulosus (61,3%), причем в отличие от северных районов, где интенсивность инвазии невысока, от 2 до 15 экз., то в центральных районах Якутии достигает от 250 до нескольких тысяч.
Генетическая дифференциация, систематическое положение и проблема охраны краевых популяций маньчжурского цокора Myospalax psilurus (Rodentia, Myospalacinae)
Павленко М.В., Кораблев В.П.
Биолого-почвенный институт ДВО РАН, Владивосток, 690022 korablev@ibss.dvo.ru
В связи с юбилейной датой Териологического общества хочется вспомнить, что более четверти века тому назад работы по сравнительной генетике подземных роющих грызунов были инициированы Вице-президентом Общества проф. Н.Н. Воронцовым.
Цокоры – древняя узкоспециализированная группа грызунов степей и лесостепей Евразии, включающая по современным представлениям не более 7 видов. Объект нашего исследования - маньчжурский цокор (МЦ). Основной ареал его лежит в пределах сев.–вост. Китая и вост. Монголии. В России представлены два краевых участка – в Забайкалье и Приморье. Систематический статус их (один подвид или два разных вида?) по-прежнему остается дискуссионным. Приморская форма включена в Красную книгу РФ (2001) как узкоареальный эндемичный подвид M. psilurus epsilanus Thomas, 1912, при этом природоохранная судьба забайкальской формы остается неясной.
Для уточнения таксономического положения этих двух форм использован классический метод электрофореза белков. Рассмотрена изменчивость белка крови трансферрина у 58 особей из 8 локалитетов. Были обнаружены два разных типа трансферрина: быстрый -TfB и медленный – TfC. Все исследованные особи из трех частично изолированных поселений Приханкайской равнины в Приморье (7 точек) мономорфны по TfB, в то время как у цокоров из Забайкалья (1 точка) был выявлен только TfC. Таким образом, на более строгом уровне при анализе нескольких выборок и достаточного, по сравнению с прежними данными (Мартынова и др., 1977) материала, получены доказательства, подтверждающие наличие фиксированного генного отличия между забайкальской и приморской формами. С позиций филогенетической концепции вида эти краевые генетически дискретные и географически разобщенные популяции должны быть отнесены к разным видам. Результаты согласуются с мнением, что на ареале МЦ обитают две хорошо дифференцированные формы видового ранга (Lawrence, 1991). Хотя таксономический и охранный статус МЦ из Забайкалья еще предстоит уточнить, предлагаем уже сейчас рассматривать эту форму как кандидата в Красную книгу РФ.
Работа частично поддержана РФФИ, гранты №№ 99-04-630049, 97-04-49793