Материалы Международного совещания [151..160]
Микроскопическая морфология мейотических хромосом Microtus arvalis из Азербайджана
Касумова Н.И., Мамедрзаева Э.Т., Кулиев Г.Н.
Институт Зоологии Национальной Академии Наук Азербайджана
370073 Азербайджан, Баку, проезд 1128, квартал 504, zoology@dcacs.ab.az
С целью выявления внутривидовой, внутрипопуляционной и межпопуляционной изменчивости проведен анализ микроскопической морфологии мейоза у 4-х географически изолированных популяций Microtus arvalis: Шемахинской (Большой Кавказ), Чайкендской, Кедабекской (Малый Кавказ), Лерикской (Ленкоранская природная область), условия обитания которых имеют четкие высотные, климатические и ландшафтные различия. Детально описаны все последовательные стадии мейоза. Пахитенный анализ выявил индивидуальную хромомерную структуру хромосом. Исследованы морфология и поведение гетероморфных хромосом от появления полового пузырька до гетеропикнотического бивалента. У- хромосомы этих популяций отличаются по размерам и наличию блоков и структурного гетерохроматина. Коньюгация половых хромосом происходит по типу "конец к концу". Наблюдались отличия в конфигурации пятого крупного бивалента, который у Лерикской популяции имеет лишь 1 хиазму. Блоки структурного гетерохроматина четко проявляются в 11-12 аутосомных бивалентах у Шемахинской, Кедабекской, и Чайкендской популяций. У особей из Лерика только 8-9 бивалентов имеют крупные гетерохроматиновые участки. Выявлены различия в форме и размерах сперматозоидов между популяциями. Индивидуальные различия в частоте анеуплоидных и полиплоидных клеток в пределах каждой группы самцов носили случайный характер. Недостоверны эти различия и между популяциями.
Многолетняя (1936-2002 гг.) динамика численности мелких млекопитающих на Кольском полуострове.
Катаев Г.Д. 1, Кошкина Т.В. 2
1Лапландский гос. природный биосферный зап., г. Мончегорск Мурманской обл.
2Москва, ул. Бутлерова, 2
Стационар по учёту численности мелких млекопитающих находится на территории Лапландского заповедника, в центральной гористой части Кольского полуострова и был заложен А.Н. Жуковым в 1936 году. С тех пор учёты на нём проводятся ежегодно, за исключением одного перерыва в военные 1942-1945 гг. На стационаре Ельнюн работали зоологи: Л.О. Белопольский (1936-1937), А.А. Насимович (1938,1940,1946), М.И. Владимирская (1939), А.Л. Герман (1958-1961), О.И. Семёнов-Тян-Шанский (1941, 1958-1973) и авторы Т.В. Кошкина (1947-1957) и Г.Д. Катаев с 1974 года по настоящее время. Местоположение стационара (67°39' N, 32° 36'E) и метод проведения учётов ни разу не меняли. Продолжающийся мониторинг сообщества мелких млекопитающих зарегистрировал cущественную трансформацию в нём. Среднегодовая суммарная численность изученных видов снизилась за полвека в 1,8 раза. Произошла смена доминирования видов. Численность европейской рыжей полёвки Clethrionomys glareolus сократилась в 6 раз. Численность красно-серой полёвки C. rufocanus, наоборот, возросла и 1,4 раза. К 2003 году завершится по прогнозу 16-й по счёту популяционный цикл фонового вида - красно-серой полёвки. Установленные ранее 4- летние циклы изменили свою продолжительность с 4 до 5 и дважды до 6 лет. Для рыжей полёвки также выявлены изменения популяционных характеристик. Если ранее каждый подъём численности продолжался два года с 4-летней цикличностью, то постепенно к 1974 году "пики" начали длиться по году, а цикл сократился до 3 лет. Кроме нарушения периодичности в числе других изменений у рыжих полёвок было отмечено сокращение периода размножения до двух выводков за сезон, а также произошло уменьшение в 10,1 раза доли вида в горно-тундровой части стационарной линии. Фаунистический состав мелких млекопитающих на стационаре Ельнюн представлен 12 видами (не отмечены 2 – Sorex minutissimus и S. isodon) и за годы наблюдений не изменился. Но гораздо реже, чем прежде на стационаре регистрируются водяная полёвка, лесной и норвежский лемминги, обыкновенная кутора.
Сообщение I. Численность краснохвостой песчанки Meriones lybicus в бассейне Кашкадарьи (Узбекистан)
Кашкаров Р.Д.
Центр профилактики карантинных и особо-опасных инфекций Министерства Здравоохранения Республики Узбекистан
700169, Узбекистан, Ташкент, ул. Эшон Бобохон, 2, cpqmhi@BCC.COM.UZ
Материалы по численности представлены данными учетов по стандартной методике на площадках размером 100X100 м (1 га). Всего в период 1956-95 гг. было заложено 328 площадок. В исследованном районе нами выделено 4 основных типа ландшафтов, по которым и сгруппированы данные.
Таблица. Численность краснохвостой песчанки в бассейне Кашкадарьи
| Ландшафт | Кол-во лет наб-людений | Число зв./га | Ср. квадрат. отклонение | Кол-во площадок | Доля учетов (%) с числом зверьков/га: | |||||
| max | Среднее многолетнее | до 1.0 | 1.1-5.0 | 5.1 -10.0 | 10.0 -20.0 | Более 20 | ||||
| Пески Сундукли | 11 | 23 | 2.9±0.4 | 2.1 | 143 | 46.1 | 37.1 | 11.2 | 4.9 | 0.7 |
| Каршинская степь | 14 | 27 | 3.1±0.6 | 2.5 | 77 | 51.9 | 29.9 | 11.7 | 3.9 | 2.5 |
| Степь Карнабчуль | 12 | 47 | 4.7±1.6 | 5.6 | 93 | 46.2 | 24.7 | 12.сен | 7.5 | 8.6 |
| Предгорья Гиссара | 4 | 20 | 4.6±1.6 | 2.7 | 15 | 26.7 | 46.7 | 13.3 | 13.3 | - |
В равнинной части наиболее низкие многолетние показатели численности - в песчаных массивах Сундукли. Наиболее высокая численность характерна для глинисто-солончаковых увалов степи Карнабчуль. Мозаичные ландшафты Каршинской степи представляют переходную зону между песчаной пустыней Сундукли и глинистой степью Карнабчуль. Из таблицы 1 видно, что во всех трех группах равнинных ландшафтов примерно половина учетов приходится на крайне низкую численность, примерно треть -на невысокую, и лишь несколько более 10 % - на среднюю. В предгорных ландшафтах численность более стабильна: крайне низкая численность отмечается вдвое реже (26.7 % учетов), более половины учетов составляют невысокие и средние показатели. На наш взгляд, немаловажную роль в этом играет исторически сложившаяся приуроченность поселений грызунов к оптимальным местообитаниям, где наименее ощутимо влияние основных лимитирующих факторов - глубокого зимнего промерзания почвы и неурожая семян эфемеров.
Сообщение П. Основные факторы многолетней динамики численности краснохвостой песчанки Meriones lybicus в равнинных ландшафтах бассейна Кашкадарьи (Узбекистан)
Кашкаров Р.Д.
Центр профилактики карантинных и особо-опасных инфекций Министерства Здравоохранения Республики Узбекистан
700169, Узбекистан, Ташкент, ул. Эшон Бобохон, 2, cpqmhi@BCC.COM.UZ
Подъемы численности краснохвостой песчанки носят непериодический кратковременный характер (Лобызова, 1972). Состояние популяции грызуна определяется успехом перезимовки и продуктивностью весенне-летнего размножения. Лимитирующими при этом являются два основных фактора: 1 - глубина промерзания почвы, 2 - урожайность семян эфемеров (Мокроусов, 1978; Ривкус с соавт., 1985). Нами были проанализированы изменения средних показателей численностей от осени (август-декабрь) к весне (февраль-апрель) 1974-75 и 1982-87 гг. в трех типах равнинных ландшафтов - песчаных массивах Сундукли, глинисто-солончаковых увалах степи Карнабчуль и в глинисто-песчаной Каршинской степи. С «наименьшими потерями» перезимовка проходила в песках Сундукли. Из 6 рассмотренных зим лишь за две численность зверьков заметно сократилась, за две -почти не изменилась. В зимние периоды 1983-84 и 1984-85 гг. в популяции наблюдался даже рост численности, поскольку имело место зимнее размножение. Несколько хуже переживали зиму грызуны в Каршинской степи. Из четырех зим указанного периода две были в целом благоприятны, но без осеннее-весеннего роста численности. В результате двух других зим численность заметно снизилась. В степи Карнабчуль все пять зим заканчивались резким снижением численности. Подобное вполне объяснимо степенью проявления в различных ландшафтах двух разбираемых жизненно-важных факторов. Глинисто-щебнистые почвы промерзают на большую глубину. В песчаных массивах это происходит в значительно меньшей степени благодаря физическим свойствам субстрата и особенностям микрорельефа. В песчаных массивах достаточно обильна семенная продукция саксаула. Весенняя вегетация травянистой растительности в засушливые годы, благодаря особенностям гидрорежима, протекает значительно успешнее, чем на прилегающих участках степи. Однако при обилии влаги урожай семян эфемеров на глинисто-щебнистых равнинах несравненно выше, чем в других типах ландшафтов. Именно эта обильная кормовая база позволяет грызунам компенсировать за весенне-летний период зимние потери численности.
Динамика осенней численности рыжей полевки Clethrionomys glareolus подзоны широколиственно-сосновых лесов и погодно-климатические факторы, ее определяющие
Каштальян А.П.
Институт зоологии НАН Беларуси 220072, ул. Академическая, 27, Минск A_Kashtalian@tut.by
Данные наблюдений за многолетней динамикой (1992-2002 гг.) численности рыжей полевки на трех постоянных пробных площадях Березинского заповедника свидетельствуют об ее ацикличности для Северной Беларуси. В тоже время, существует строгая синхронность в ее изменении для всех исследованных стационаров. Нами рассмотрена взаимосвязь осенней численности с погодно-климатическими показателями предыдущей осени, зимнего периода, весны в период начальной растительной вегетации и репродуктивного (май-август) сезона. Наиболее тесная связь отмечена с суммой осадков весны и отдельных весенних месяцев, суммой среднесуточных температур апреля-мая, гидротермическим коэффициентом мая, суммой эффективных осадков весны. На основе полученных корреляций для двух исследованных стационаров вычислены прогнозные уравнения динамики численности по сумме среднесуточных температур апреля-мая (z) и количеству осадков в мае текущего года (y). Для участка смешанного леса среди сплошного лесного массива оно выглядит следующим образом:
x= -28,412-0,391y+0,167z
а для изолированного на болотном массиве лесного острова имеет вид
x= -67,556-0,788y+0,31z
По обоим уравнениям была рассчитана прогнозная численность животных на период с 1992 по 2002 г. Полученные результаты показывают, что уравнения с высокой степенью достоверности (± 30%) прогнозируют осеннюю динамику численности для лет с высоким и умеренным летним увлажнением, однако непригодны для составления прогнозов в годы с сухим летом. По всей видимости, для подобных лет, уравнения нуждаются в корректировке либо путем придания им нелинейной характеристики, либо введением третьей переменной.
О влиянии погодно-климатических факторов на осеннюю динамику численности обыкновенной бурозубки Sorex araneus в северной части Беларуси
Каштальян А.П.
Институт зоологии НАН Беларуси 220072, ул. Академическая, 27, Минск A_Kashtalian@tut.by
На основе данных осенних учетов 1992-2001 годов, регулярно проводившихся на трех постоянных пробных площадях Березинского заповедника, рассматривается влияние погодно-климатических факторов на уровень численности обыкновенной бурозубки Sorex araneus. Динамика численности данного вида в условиях подзоны дубово-темнохвойных подтаежных лесов имеет 3-4 летние периоды между пиками. Для каждого из исследованных биотопов выявлена собственная связь осенней динамики численности обыкновенной бурозубки с погодно-климатическими показателями. На основе полученных корреляций для одной из пробных площадей составлены уравнения, описывающие связь осенней численности вида с суммой среднесуточных температур периода вегетации (апрель-август) (z) и максимумом мартовских температур (y):
x= -78,967+1,353y+0,034z;
с суммой осадков за предыдущий год (z) и суммой осадков за июнь предыдущего года (y):
x= -20,7624+0,034865y+0,05z
Уравнения пригодны для описания особенностей движения численности вида, однако не дают ее точного прогноза.
Вес шкурки соболя Martes zibellina как морфологический признак
Кельбешеков Б.К.
Гос. природный заповедник «Столбы» 660006. г.Красноярск, ул.Карьерная 26а stolby@ktk.ru
Кожный покров, как и все органы животного, обладает определенными параметрами. Площадь, линейные размеры его находятся в прямой зависимости от размера животного (Шмид-Ниельсен, 1987). Поэтому по характеристике шкурки можно судить о размере животного. Шкурка соболя снимается с туши полностью, хорошо очищается от прирезей и жира и является хорошо препарированный орган. Для анализа пригодны все целые шкурки в зимнем меху, без признаков линьки. Линейные размеры не отражают объективную картину, т. к. они консервируются в разных пропорциях. Всего изучено более 3 тыс. шкурок соболей из 32 пунктов из разных частей ареала вида, заготовленные в сезоне охоты 1997-1998 гг. Сравнивались распределение шкурок по весу между разными пробами по критерию Колмогорова-Смирнова (Лакин,1973). Часть шкурок самцов и самок по весу не отличались, но в большинстве случаев на этом материале половой диморфизм был выражен четко. Обнаружено, что на западной части ареала вида от Урала до р.Лены, и на юг до Алтае-Саянской горной страны, обитает соболь в популяции которого доминируют крупные животные. Средний вес шкурки самца в пределах 87,5 –97,3г., а самки – 65,4 – 72,5г. В пределах Алтае-Саянской горной страны, Витимского плоскогорья (Ленский район Якутии, Каларский район Читинской области, Нижнеангарский район Бурятии) и, по всей вероятности, на северо-восток до Чукотки обитает соболь, в популяциях которого много особей среднего размера. Средний вес шкурки самца в пределах 81,4 –85,6г, а самки –51,1-69,8г. Между этими двумя клинами существует переходная зона, приуроченная к северному макросклону Алтая(Таштагольский район Кемеровской обл.), Саяна (Ермаковский, Курагинский и Манский районы Красноярского края). Мелкие соболя преобладают на острове Сахалин и в Уссурийской тайге. Шкурка самца сахалинского соболя весит в среднем 70.1г, а самки - 50,2г. От них существенно не отличаются уссурийские соболя (средний вес шкурки самца 70.6 г. и 53.3 г - самки). Шкурки самцов соболей из п. Билибино по размеру занимают промежуточное положение между приморскими и енисейскими (средний вес шкурки 86,3г), а самки почти не отличаются от сахалинских и приморских (средний вес шкурки 58,8 г). Такое распределение, по-видимому, вызвано происхождением их от акклиматизированных амурских соболей (Абрамов, 1967). Хотя не исключено, что вдоль азиатского побережья Тихого океана проходит еще один клин и тут обитает относительно мелкий соболь. Несколько обособленно от основных популяций отстоят камчатские соболя. Они по размеру значительно крупнее материковых. Средний вес шкурки самца 117,8 г., а самки –90,0 г. На основе анализа весовых характеристик шкурок соболей получены данные по внутривидовой систематике соболя. Если Г.И. Монахов (1976) по промерам черепов считад, что от Урала до Камчатки обитает соболь крупного размера, то по нашим данным крупный соболь обитает от Урала до р.Лены, а на участке от р. Лена до Тихого океана обитает соболь среднего размера. Г.И. Монахов считал, что на юге-западе Алтая обитает самый крупный соболь. На основе изучения 41 шкурки видно, что алтайский соболь по размеру средний. Вес 8 шкурок из аборигенной популяции был в пределах изменчивости соболей Алтая и Саян. Наличие особо крупного соболя на юго-западной оконечности ареала вида ничтожно мало. Рекомендуется использовать вес шкурки соболя в зоологических, охотоведческих, товароведческих исследованиях.
Остатки млекопитающих из Гнездово
Кириллова И.В.
Палеонтологический институт РАН 117868 Москва, Профсоюзная, 123 ikiril@paleo.ru
Гнездовский комплекс археологических памятников расположен на правом низком берегу р. Днепр в 15 км западнее Смоленска. Кости млекопитающих происходят из краевой части селища, расположенной в тыловой части поймы Днепра на месте заросшей протоки (раскопки В.В.Мурашевой, ГИМ).
Кости из 1-4 горизонтов имеют плохую сохранность: сильно фрагментированы и обуглены. Основная масса костей происходит из самого древнего, 5 гор-та (Х в.), сложенного песком мощн. до 0,8 м (результат постоянной засыпки древними жителями топкого места). Хорошая сохранность их обусловлена повышенной влажностью горизонта. Многие кости несут следы разрубания, собачьих погрызов или обугливания; единичные экземпляры, судя по состоянию компакты, подверглись воздействию желудочного сока. Все это типично для кухонных отходов. Обнаружено 837 костей, из них определимых - 587. Кости птиц и рыб отсутствуют. Доминируют остатки домашних животных: 95% (табл.). Из них преобладает крупный рогатый скот (к.р.с.) - 69%; доля свиньи - 20%, лошади и мелкого рогатого скота (м.р.с.) - по 5%. Количественная иерархия остатков животных разных видов в других горизонтах не сохраняется.
Охота не играла роли в пищевом рационе жителей. Основным источником животного белка был к.р.с. Две 1-е фаланги к.р.с. имеют сильно измененные («растоптанные») суставные поверхности и разросшиеся остеофиты, что свидетельствует о применении животных еще и в качестве тягловой силы. Торговые и иные связи между норманнами и славянами, запечатленные в уникальных археологических находках, в остеологических материалах не отражены.
Таблица. Млекопитающие из гор. 5 Гнездово
| Животное | Число остатков | % |
| Домашние | ||
| Bos taurus, к.р.с. | 363 | 69.15 |
| Sus scrofa, cвинья | 107 | 20.38 |
| М.р.с., из них: Capra hircus, коза – 3; Ovis aries,овца– 9 | 26 | апр.95 |
| Equus caballus, лошадь | 25 | апр.76 |
| Canis familiaris, cобака | 4 | 0.76 |
| Всего | 525 | 100.0 |
| Дикие: | ||
| Castor fiber, бобр | 2 | |
| Ursus arctos, медведь | 1 | |
| Capreolus sp., косуля | 1 | |
| Lepus sp., заяц | 1 | |
| Всего | 5 | |
| Млекопитающие, ближе не определимые: | ||
| крупных размеров | 44 | |
| средних размеров | 13 | |
| Итого | 587 | |
Влияние пола хозяина на состав гельминтов обыкновенной бурозубки
Кириллова Н.Ю.
Самарский гос. университет
445003, г.Тольятти, ул. Комзина, 10, ИЭВБ РАН ecolog@attack.ru
Целью нашей работы было изучение влияния пола хозяина на формирование его гельминтофауны. В течение полевого сезона 2001 года методом полного гельминтологического вскрытия (Скрябин, 1928) было обследовано 280 особей обыкновенной бурозубки (139 самцов и 141 самка) в двух точках Самарской Луки: Жигулевский гос. заповедник (ЖГЗ, п. Бахилова Поляна) и Мордовинская пойма (п. Мордово). Всего обнаружено 23 вида паразитических червей. Общими для самцов и самок обыкновенной бурозубки являются 18 видов гельминтов. 5 видов паразитов отмечены только у самцов: трематоды Neoglyphe sobolevi, Rubenstrema exasperatum, цестоды Vigisolepis spinulosa, Staphylocystis furcata и скребень Giganthorhynchus circumflexus, что подтверждает более богатый пищевой рацион самцов обыкновенной бурозубки. Наши иследования не выявили достоверно большей зараженности самцов обыкновенной бурозубки по сравнению с самками. Можно отметить лишь относительно большее количество видов гельминтов у самцов землеройки. Так, в Мордовинской пойме у самцов обнаружен 22 вида паразитов, а у самок - 17, в ЖГЗ у самцов землеройки – 20 видов гельминтов, у самок – 17 видов. Отмечена относительно большая зараженность самок бурозубки цестодами. В Мордовинской пойме зараженность самок составила 87,7%, самцов – 78,9; в ЖГЗ – 98,8% и 97,1%, соответственно. При анализе распределения нематод, трематод и скребней было установлено, что экстенсивность заражения самцов этими систематическими группами паразитов относительно выше, чем у самок. Результаты исследований показали, что, хотя самцы землероек заражены относительно сильнее, статистически достоверных различий в зараженности гельминтами обыкновенной бурозубки разного пола нет.
Сезонные изменения гельминтофауны обыкновенной бурозубки Самарской Луки
Кириллова Н.Ю. 1, Кириллов А.А. 2
1 Самарский гос. университет
2 Институт экологии Волжского бассейна РАН, г. Тольятти
Изучение сезонных изменений состава гельминтов обыкновенной бурозубки проводились в период с мая по сентябрь 2001 года.Методом полного гельминтологического вскрытия (Скрябин, 1928) было обследовано 280 особей обыкновенной бурозубки в двух точках Самарской Луки: Жигулевский гос. заповедник (ЖГЗ, п. Бахилова Поляна) и Мордовинская пойма (п. Мордово). Наибольшее количество видов гельминтов было обнаружено в июле – 18, наименьшее – в мае и сентябре – 9-13 видов паразитов. 9 видов гельминтов обнаруживаются на протяжении всех месяцев исследований. Можно говорить об относительном постоянстве состава гельминтов землеройки в течение исследуемого периода. Анализируя сезонные изменения гельминтофауны обыкновенной бурозубки в обоих районах исследований можно отметить, что землеройки наиболее сильно заражены в середине лета, как по количеству видов, так и по показателям зараженности. В июле экстенсивность заражения гельминтами в ЖГЗ составила 50,8%, а в Мордовинской пойме - 60,3%. Основу гельминтофауны обыкновенной бурозубки в обоих районах исследований на протяжении всего сезона составляют нематоды. Зараженность землеройки нематодами возрастает к середине лета (июль-100%) и убывает осенью (сентябрь-87,5%). На формирование гельминтофауны обыкновенной бурозубки оказывают влияние различные факторы, в частности, на зараженность животного цестодами и трематодами влияют особенности пищевого рациона в разные сезоны года, а при инвазии землеройки геонематодами (Longistriata codrus и paradoxi) определяющее значение имеет влажность среды. Различия в зараженности бурозубки гельминтами в разные сезоны года связаны с трофической адаптацией животного в условиях изменяющихся абиотических факторов. В разные сезоны года в рационе землеройки могут доминировать различные виды беспозвоночных, при поедании которых происходит заражение бурозубки.
Границы ареалов даурского и маньчжурского цокоров в Забайкалье
Кирилюк В.Е. 1, Кораблев В.П. 2
1Гос. природный биосферный заповедник «Даурский», 672020 Чита, 1-й мкр, 38-67, kiriliuk@daur.chita.ru
2Биолого-почвенный институт ДВО РАН, 690022 Владивосток, Столетия 159, korablev@ibss.dvo.ru
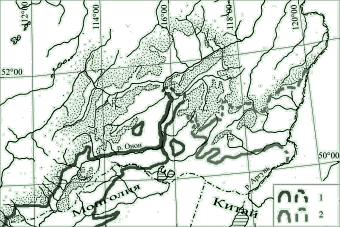 Во всех последних сводках границы распространения даурского Myospalax aspalax и маньчжурского M. psilurus цокоров на стыке ареалов приводятся с большими разночтениями. Большинство составителей опираются на работы Н.В. Некипелова и В.Н. Скалона (1936 и др.), а также монографию С.И. Огнева (1947), обобщившего предыдущие исследования. Более свежих данных нет. Нами в ходе полевых исследований уточнены границы обитания видов по наличию характерных выбросов земли. Во многих местах на стыке ареалов производились отловы и выборочное кариотипирование цокоров обоих видов, хорошо дифференцируемых также по окраске. Участки совместного обитания не выявлены. Отмеченное Н.В. Некипеловым и В.Н. Скалоном «смешение» видов в окрестностях Цаган-Олуя пока не подтвердилось – в этом районе и по всему Нерчинскому хребту отмечен только маньчжурский цокор. Вероятно, в последние десятилетия здесь произошло вытеснение даурского цокора. Не исключено также, что упомянутые авторы ссылаются на особей, взятых у заготовителей и отловленных в другом месте. Во всяком случае, в более поздней работе, непосредственно касающейся распространения млекопитающих в регионе (Некипелов, 1961), о совместном обитании двух видов под Цаган-Олуем уже ничего не говорится, но вновь упоминается о возможном смыкании ареалов в двух других местах. По нашему мнению, если совместное обитание и имеет место, то на крайне ограниченных по площади и единичных участках. В целом, для зоны, где начинается ареал маньчжурского цокора характерно значительно большее увлажнение и другой состав почв.
Во всех последних сводках границы распространения даурского Myospalax aspalax и маньчжурского M. psilurus цокоров на стыке ареалов приводятся с большими разночтениями. Большинство составителей опираются на работы Н.В. Некипелова и В.Н. Скалона (1936 и др.), а также монографию С.И. Огнева (1947), обобщившего предыдущие исследования. Более свежих данных нет. Нами в ходе полевых исследований уточнены границы обитания видов по наличию характерных выбросов земли. Во многих местах на стыке ареалов производились отловы и выборочное кариотипирование цокоров обоих видов, хорошо дифференцируемых также по окраске. Участки совместного обитания не выявлены. Отмеченное Н.В. Некипеловым и В.Н. Скалоном «смешение» видов в окрестностях Цаган-Олуя пока не подтвердилось – в этом районе и по всему Нерчинскому хребту отмечен только маньчжурский цокор. Вероятно, в последние десятилетия здесь произошло вытеснение даурского цокора. Не исключено также, что упомянутые авторы ссылаются на особей, взятых у заготовителей и отловленных в другом месте. Во всяком случае, в более поздней работе, непосредственно касающейся распространения млекопитающих в регионе (Некипелов, 1961), о совместном обитании двух видов под Цаган-Олуем уже ничего не говорится, но вновь упоминается о возможном смыкании ареалов в двух других местах. По нашему мнению, если совместное обитание и имеет место, то на крайне ограниченных по площади и единичных участках. В целом, для зоны, где начинается ареал маньчжурского цокора характерно значительно большее увлажнение и другой состав почв.
Рис. Подтвержденная и вероятная граница обитания даурского (1) и маньчжурского (2) цокоров в Забайкалье.
О расселении дзерена Procapra gutturosa в Забайкалье
Кирилюк В. Е. 1, Лущекина А. А. 2
1Гос. природный биосферный заповедник «Даурский», 674480 Читинская область, с. Н.Цасучей kiriliuk@daur.chita.ru
2Институт проблем экологии и эволюции им. А. Н. Северцова, РАН, 119071
г. Москва, Ленинский просп., 33, mab.ru@relcom.ru
Изучение особенностей и причин массовых миграций копытных имеет не только научное, но и практическое значение. Возобновление миграций дзерена в Россию и начавшееся постепенное восстановление крайне редкого для страны вида дает хороший шанс для эффективной реализации конкретных природоохранных программ и международных соглашений по сохранению мигрирующих животных. Во время зимней миграции в начале 2001, вызванной экстремальными погодными условиями, в Юго-Восточное Забайкалье из Монголии заходило около 45-70 тысяч дзеренов, в том числе около 20-25 тысяч вглубь территории. Часть особей осела в местах зимовки. В России к началу отела в июне 2001 г. общая численность дзеренов составила 550-800 голов, из них в окрестностях заповедника, главным образом в его охранной зоне, насчитывалось около 400 голов. К началу отела 2002 г. в окрестностях заповедника оставалось 290-310 особей, а после размножения, к октябрю, численность достигла 420-450 особей. Вдалеке от заповедника во многих местах к этому времени сохранились мелкие группки, но их общая численность со времени, прошедшего после упомянутой миграции, сильно сократилась и не превышает, вероятно, 100 голов. За два года после миграции 2001 г. всесторонние меры по сохранению дзерена, поддержанные многими фондами и организациями, привели к стабилизации численности антилоп в охранной зоне заповедника (заповедник почти на 80% состоит из водно-болотных угодий, а кластерные степные участки малозначительны для вида). Наблюдается незначительное расселение животных с охранной зоны на неосвоенные видом прилегающие территории. Необходимо расширить заповедник и его охранную зону, продолжить интенсивную оперативную охрану дзерена и реализовать другие меры для его восстановления в России. Важное значение имеет разъяснительная работа среди населения, направленная на формирование отношения к дзерену, как к исконному забайкальскому животному, а не временному мигранту.
Современное распространение европейской норки на Урале
Киселева Н.В., Потапкин А.Б.
Ильменский гос. заповедник УрО РАН
456317, Челябинская область, г.Миасс, Ильменский заповедник, nk@ilmeny.ac.ru
Сохранение биологического разнообразия – является в настоящее время одним из приоритетных направлений в охране окружающей среды. Особого и подчас срочного внимания требуют к себе животные, находящиеся под угрозой исчезновения. Среди всех млекопитающих Уральского региона в наиболее угрожаемом состоянии находится европейская норка. Она включена в Красные книги Башкирии, Свердловской, Пермской, Оренбургской областей и проект Красной Книги Челябинской области. Восточная граница естественного ареала европейской норки проходит почти сразу за Уральским хребтом. Однако сведения о характере ее прохождения у разных авторов существенно различаются. По данным уральского естествоиспытателя С.А. Куклина северный предел распространения вида в середине 30-х г.г. ХХ в. проходил через верховья реки Конды, далее граница распространения доходила до пересечения реки Лозьвы с 60-й параллелью, отсюда - на город Ирбит и далее - на восток, огибая с севера Тюмень, шла к югу, к г. Ялуторовску и - до 56-й параллели, откуда довольно правильной прямой линией - на юго-запад, на г. Магнитогорск. Восточней этой границы европейская норка встречалась очень редко, хотя отдельные экземпляры встречались в верховьях реки Северная Сосьва. В последующие годы в связи с акклиматизацией американской норки невозможно проследить за изменениями, происходившими с европейской норкой. В Челябинской области до середины 80-х годов европейская норка встречалась в Миасском районе в верховьях рек Атлян и Большой Киалим, в Саткинском районе на реках Малая Сатка и Тюлюк. В настоящее время европейская норка еще встречается на реках Березяк и Юрюзань. Численность европейской норки в этих районах низка и обитает она совместно с американским видом. Помимо Челябинской области, есть данные о том, что европейская норка обитает в Мелеузском районе Башкирии, в Невьянском районе Свердловской области и сохранилась в Тюменской области.
Сравнительный анализ случаев гибели трех видов куньих
Киселева Н.В., Ларина Ю.В.
Ильменский гос. заповедник УрО РАН
456317, Челябинская область, г. Миасс, Ильменский заповедник, kn@ilmeny.ac.ru
Проблема сохранения европейской норки остается до сих пор открытой, т. к. не ясны причины приводящие к сокращению численности этого вида и его ареала. В этой связи факты, вызывающие гибель животных, должны анализироваться особенно тщательным образом. Нами проведен сравнительный анализ случаев гибели 3-х видов куньих: хорька, европейской и американской норок, содержащихся в питомнике Ильменского заповедника. Наиболее часто гибель норок наблюдалась при наличии дисбаланса в соотношении белковой и углеводной составляющих в рационе животных. При этом по сравнению с американской норкой и хорьком, европейская норка проявляла большую склонность к различным пищевым интоксикациям и заболеваниям, вызываемым условно патогенной микрофлорой (стафилококкозы, ишерихозы, авитаминозы), а также грибковым поражениям (микроспория, аспергиллез). Процент поражения ими европейской норки доходил до 82-100%, тогда как у американской он составлял 42-70%, у хорьков – 15-26%. При возникновении этих патологий смертность европейской норки держалась в этих же рамках. Американская норка гибла в 35-61% случаев, хорьки – 10%. Высокая заболеваемость европейских норок и высокий процент летальности возможно связан с пониженным иммунитетом животных этого вида. Цитологический анализ крови показал, что общее количество лейкоцитов, фагоцитов, базофилов и других клеток крови у европейских норок во время болезни было ниже, чем у хорьков и американских норок, что указывает на низкую сопротивляемость организма инфекции и создает возможность наслаивания различных инфекций и патологических факторов. У американской норки общее количество клеток крови, отвечающих за иммунитет, было на 12-15% больше, что обусловливает ее относительную устойчивость и возможность сопротивления секундарной микрофлоре. Хорьки показали самый высокий цитофактор, что естественно сказывается на сопротивляемости патологическим влияниям и на выживаемости вида в целом. Но особенно важно отметить то, что у здоровых животных, как у американского, так и европейского вида, цитологическая картина крови практически идентична.
Влияние зараженности гельминтами на развитие молодняка зубров
Киселева Е.Г., Цибизова Е.Л.
Окский биосферный гос. природный заповедник
391072, Рязанская обл., Спасский р-он, п/о Лакаш
Гельминты отрицательно влияют на упитанность, продуктивность, а главное – на успешное выращивание молодняка. Они оказывают разнообразное воздействие на организм животного-хозяина: нарушают морфологические и биохимические показатели крови, минеральный обмен, вызывают глубокие морфологические изменения и нарушения функций желудочно-кишечного тракта и т.д. Характер и степень проявления этого действия зависит от вида и интенсивности инвазии, стадии развития паразитов и индивидуальных особенностей организма животного. Анализ вскрытых зубров показал, что зараженность гельминтами сказывается на росте и развитии молодняка. Инвазированные животные растут медленнее, чем их малозараженные собратья. В таблице 1 представлены данные по росту и развитию телят, сопоставлен размер и вес разновозрастных особей одного пола (самцы) с показателями интенсивности инвазии. Кормление телят было одинаковым.
Таблица. Влияние зараженности гельминтами на развитие молодняка
| Возраст мес. | Вес кг | Интенс. инваз. экз. | Абсолютный вес в г | Высота в: | Общая длина тела, см | Косая длина тулов., см | Обхват груди, см | ||||
| сердце | печень | почки | селезенка | холке, см | крестце, см | ||||||
| 6 | 92 | 32 | 700 | 1300 | 700 | 300 | 107 | 110 | 113 | 101 | 138 |
| 10 | 72 | 8905 | 580 | 800 | 312 | 124 | 112 | 114 | 148 | 97 | 110 |
| 14 | 257 | 22 | 1950 | 3800 | 850 | 770 | 158 | 147 | 208 | 142 | 170 |
| 14 | 157 | 10392 | 958 | 2050 | 380 | 198 | 132 | 130 | 174 | 122 | 134 |
Данные позволяют сделать вывод, что при резком увеличении зараженности зубрят, интенсивность роста молодняка снижается. У особей с количеством паразитов 8905 и 10392 экз. отмечено значительное отставание в росте, чем у особей со слабой степенью зараженности – 32 и 22 экз. Вес сильно зараженных телят в 1.2 – 1.4 раза меньше веса зубрят менее зараженных.
К изучению подвижности домовых мышей в лабораторных условиях
Климов А.С., Дуванова И.А.
Воронежский гос. университет bstmz288@main.vsu.ru oriolus@zoo.vsu.ru
При помощи часового механизма и электромагнитного писчика, регистрирующего каждый оборот жестяного барабана-колеса, помещенного в клетку с домовой мышью, фиксировали время, которое зверек тратил на бег в этом свободно вращающемся колесе. Наблюдения проводили в трех клетках в разные годы на 12 особях домовых мышей. Зверьки содержались в помещении, редко посещаемом людьми и плохо обогреваемом в зимнее время (t° воздуха около 10°-12° C). Наблюдения проводились с января по август, включительно. Известно, что многие зверьки в неволе охотно и подолгу бегают в свободно вращающемся барабане-колесе. Вероятно, этим они избавляются от избыточной энергии и снимают стрессы, вызванные неволей. Очевидно, что эта их особенность в какой-то мере отражает и их природную потребность в движении. Это подтверждается тем, что частота и продолжительность бега домовых мышей в таком колесе в разные месяцы года не одинакова. В январе-феврале средняя продолжительность бега неравномерна, подвержена резким колебаниям. В течение суток наблюдается три пика повышения подвижности (в 1-5, в 10-13 и 19-20 часов), когда продолжительность бега достигает 40-45 минут в час, и три спада (в 7-8, 15-17 и 21-22 часа) с минимальными значениями подвижности до 10 минут бега в час. В марте-апреле также наблюдается по три пика подъема и спада подвижности примерно в те же часы, что и зимой, однако общая продолжительность бега постепенно снижается и проявляется тенденция к снижению и стабилизации подвижности в светлое время суток. К концу весны подвижность мышей оставалась стабильной большую часть суток (с 2 до 19 часов), колеблясь около 20 минут активности в час и увеличиваясь в ночное время (с 20 до 1 часа) до 45-47 минут бега в час. В летнее время происходит постепенное снижение подвижности зверьков в светлое время суток (с 6 до 17 часов) до 7-10 минут бега в час в июне и до значений, близких к нулю в июле-августе. Ночная же активность остается стабильно высокой (с 19 до 2 часов) до 40-45 минут активного бега в час.
Морфофункциональные последствия превалирующей ориентации рукокрылых в гравитационном поле Земли
Ковалева И.М., Тараборкин Л.А.
Институт зоологии им.И.И.Шмальгаузена НАН Украины
01602 Украина, Киев ГСП 30, ул. Б. Хмельницкого, 15 ikov@iz.freenet.kiev.ua
Национальный технический ун-т Украины «Киевский политехнический институт»
03056, Украина, Киев 56, просп. Перемоги, 37
leotar@paton.kiev.ua, leotar@naeps.ntu-kpi.kiev.ua
Проведенные морфологические исследования различных структур и органов рукокрылых, в частности, опорно-двигательных, респираторных, кровеносных, показывают не только разнообразие их строения, но и позволяют зафиксировать факты, достоверно характеризующие их асимметрию (Kovalyova, Taraborkin, 2001; Ковалева, Тараборкин, 2003 и др.). Вместе с тем оказывается, что использование классических подходов сравнительно-морфологического, палеонтологического, эмбриологического методов исследования не дает и, видимо, не может дать однозначного ответа на ряд вопросов по формообразованию морфологических структур. Решающим моментом в данной работе стало привлечение к анализу полученных данных ранее не принимавшегося во внимание гравитационного фактора, действие которого рассматривается не только в пространстве (с учетом направленности вектора силы тяжести), но и во времени. Учет этого абиотического фактора позволяет ответить на ряд основных вопросов. В частности, с помощью предложенного подхода удалось получить удовлетворительное объяснение возникновения асимметрии легких и различия в подвижности опорно-двигательного аппарата рукокрылых.